Découverte d'une nouvelle forme inactive de protéine p38α
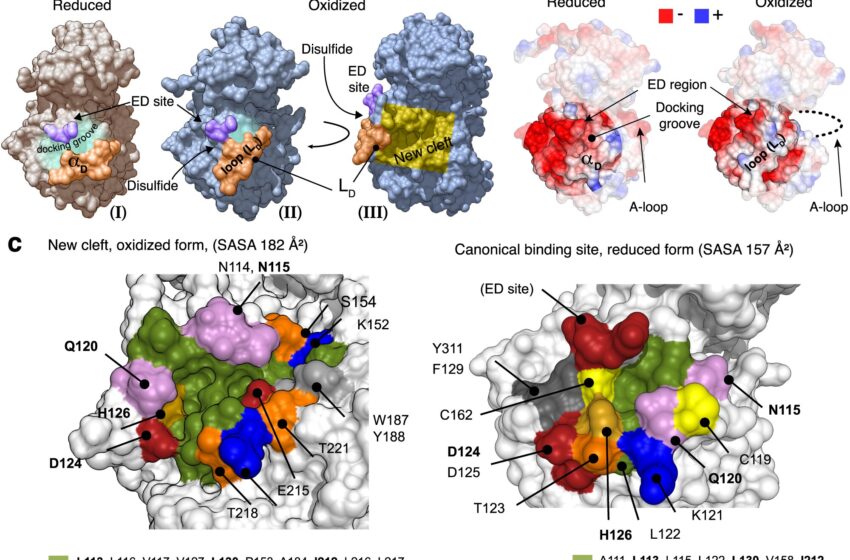
Propriétés structurelles du site de liaison canonique et de la fente de p38α. Crédit: Communications naturelles (2023). DOI : 10.1038/s41467-023-43763-5
La protéine p38α, une enzyme clé dans la régulation de diverses fonctions cellulaires, joue un rôle crucial dans certaines maladies, notamment le cancer, l'inflammation chronique et les maladies neurodégénératives. Depuis la découverte de p38α, diverses sociétés pharmaceutiques et de nombreux groupes de recherche ont consacré des efforts considérables au développement d'inhibiteurs de cette protéine. Cependant, les résultats n’ont pas répondu aux attentes prévues pour pouvoir concevoir des médicaments.
Une équipe de chercheurs dirigée par le Dr Maria Macias et le Dr Angel R. Nebreda, tous deux chercheurs ICREA à l'IRB Barcelone, a découvert que p38α adopte une conformation non décrite auparavant. En bref, ils ont révélé une nouvelle forme « oxydée », dans laquelle s'établit un pont disulfure.
La protéine adopterait cette forme temporairement en fonction de l'état rédox de la cellule. Cette nouvelle forme de p38α, décrite dans la revue Communications naturelles, ne permet pas la liaison avec des activateurs ou des substrats et est donc incapable de remplir ses fonctions caractéristiques. Cependant, ce processus est réversible et la fonction des protéines est récupérée dans des conditions réductrices.
“L'identification d'une nouvelle forme de p38α pourrait expliquer les difficultés rencontrées précédemment dans la conception d'inhibiteurs efficaces de p38α, les études se concentrant jusqu'à présent sur des conformations réduites. Nos résultats ouvrent de nouvelles voies pour le développement de composés thérapeutiques modulant plus précisément l'activité de p38α.” explique le Dr Macías, chercheur à l'ICREA et responsable du laboratoire de caractérisation structurale des assemblages macromoléculaires à l'IRB Barcelone.
Une forme oxydée et une forme réduite
La Protein Data Bank contient 357 structures de la protéine p38α, mais elles correspondent toutes à sa forme réduite, la seule connue à ce jour. La prédominance de cette forme est peut-être due à la prédominance de conditions expérimentales incluant des agents réducteurs dans les études structurales réalisées.
Sous la forme oxydée décrite dans cette étude, un pont disulfure est établi, ce qui force un changement de conformation et bloque l'accès au site de liaison des activateurs et des substrats. Il s’agit donc d’une nouvelle forme inactive de p38α, qui serait présente dans certaines conditions cellulaires.
“L'étude des kinases sous leurs formes oxydées est complexe en raison de l'influence des conditions de stress oxydatif et du caractère éphémère de ces formes dans l'environnement cellulaire”, expliquent les Drs. Joan Pous et Pau Martin Malpartida et le doctorant Blazej Baginski, premiers auteurs de l'étude. “Cependant, la clé pour les traiter efficacement d'un point de vue pharmacologique réside peut-être dans ces formes”, concluent-ils.
Une approche prometteuse
Cette nouvelle forme illustre un mécanisme d'action de p38α régulé par l'état rédox cellulaire, expliquant ainsi les observations biochimiques décrites à ce jour mais sans base moléculaire structurale.
Dans les travaux futurs, les chercheurs se concentreront sur l’exploration de nouvelles cavités d’interaction qui apparaissent sous forme oxydée, car elles pourraient aider à inactiver la protéine sans interférer avec le centre catalytique, gagnant ainsi en spécificité.
Le travail a été développé en collaboration avec le laboratoire du Dr Modesto Orozco de l'IRB Barcelone et de l'Université de Barcelone, et Nostrum Biodiscovery.
Plus d'information:
Joan Pous et al, Base structurelle d'un commutateur conformationnel dépendant du rédox qui régule la kinase de stress p38α, Communications naturelles (2023). DOI : 10.1038/s41467-023-43763-5
Fourni par l'Institut de recherche en biomédecine (IRB Barcelone)
Citation: Une nouvelle forme inactive de protéine p38α découverte (19 décembre 2023) récupérée le 19 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
