Une recherche massive de médicaments découvre une molécule infinitésimale qui tue les cancers tout en épargnant les cellules immunitaires
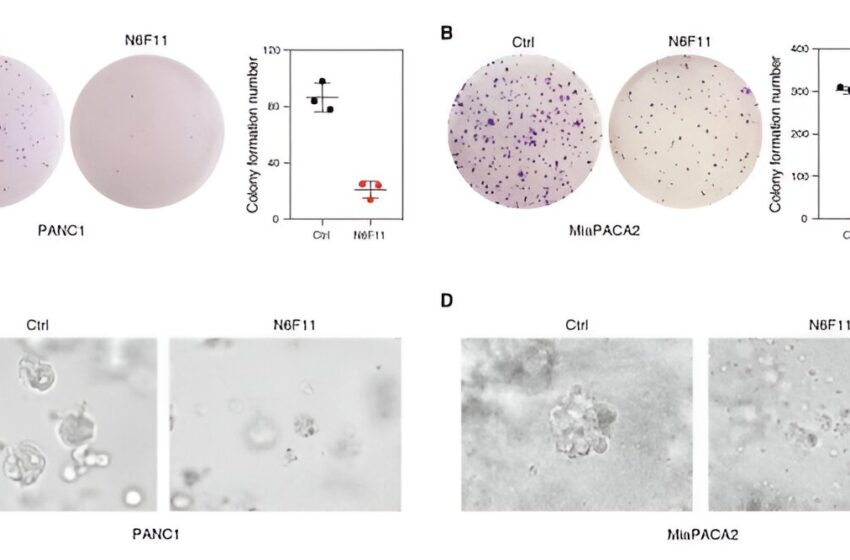
N6F11 supprime la croissance du PDAC humain. (A) Les cellules PANC1 ont été prétraitées avec du DMSO ou du N6F11 (5 µM) pendant 12 heures. (B) Les cellules MiaPACA2 ont été prétraitées avec du DMSO ou du N6F11 (5 µM) pendant 12 heures. (C) Effets de N6F11 sur la croissance des sphéroïdes tumoraux PANC1 3D pendant des périodes croissantes. (D) Effets de N6F11 sur la croissance des sphéroïdes tumoraux MiaPACA2 3D pendant des périodes de temps croissantes. Crédit: Médecine translationnelle scientifique (2023). DOI : 10.1126/scitranslmed.adg3049
Les scientifiques ont découvert une petite molécule expérimentale qui induit une forme de mort cellulaire pour tuer divers cancers tout en renforçant la puissance du système immunitaire et en laissant les cellules saines totalement indemnes.
La molécule déclenche la ferroptose, une forme unique de mort cellulaire qui est de plus en plus testée comme stratégie anticancéreuse. L'équipe internationale de scientifiques a publié ses conclusions dans la revue Médecine translationnelle scientifique.
Pour les étudiants en biologie, les trois principales formes de mort cellulaire sont bien connues et enseignées dès le premier cycle des cours de biologie générale du premier cycle. Il s’agit de l’apoptose, ou mort cellulaire de type 1 ; autophagie, mort cellulaire de type 2 ; et la nécrose cellulaire, ou type 3. La ferroptose, en revanche, est une forme distincte de mort cellulaire qui repose sur une accumulation de fer et la génération d'espèces réactives de l'oxygène, qui finissent par provoquer l'autodestruction d'une cellule condamnée.
Il est vital de se tourner vers une autre forme de mort cellulaire, car la plupart des formes de traitement du cancer déclenchent aujourd’hui la mort cellulaire par apoptose enzymatique-dépendante. Malheureusement, l’une des principales caractéristiques des cancers humains est leur capacité à développer une résistance au traitement, et de nombreux types de tumeurs ont développé de manière choquante une résistance à l’apoptose, d’où la recherche d’une autre manière de tuer les cellules tumorales.
Aussi intrigante que puisse paraître la ferroptose comme alternative, elle n’est pas encore prête à être exploitée comme thérapeutique formelle pour traiter les cancers chez l’homme. Mais le fait qu'il ne soit pas encore prêt à être diffusé en prime time ne signifie pas qu'il ne le sera pas dans un avenir pas trop lointain.
“Nous pensons qu'une telle approche justifie une évaluation préclinique plus approfondie en vue de son éventuelle incorporation dans l'arsenal oncologique”, écrit l'auteur principal, le Dr Jingbo Li, chercheur au département de chirurgie du centre médical du sud-ouest de l'Université du Texas à Dallas, au Texas. Li est également affilié au département de gastroentérologie de l'hôpital Xiangya de l'université Central South à Changsha, en Chine.
Même si la ferroptose est activement recherchée comme traitement potentiel du cancer, d'autres chercheurs étudient le processus pour son rôle pathologique dans diverses maladies disparates allant de la maladie d'Alzheimer aux maladies cardiovasculaires et même à diverses formes de cancer. La ferroptose est intimement impliquée dans les processus pathologiques de ces affections, ont montré des études.
En ce qui concerne l'exploitation de cette forme de mort cellulaire à des fins thérapeutiques, des équipes du monde entier s'efforcent de surmonter un certain nombre d'énigmes, en particulier ce que l'on appelle les activités « non sélectives » de la mort cellulaire ferroptotique. Elle ne tue pas seulement les cellules cancéreuses, elle tue une multitude de cellules dans le micro-environnement immédiat, en particulier les trois grands : les cellules dendritiques, les cellules T et les neutrophiles, ce qui semble contrecarrer la promesse que la ferroptose tient en tant que combattant du cancer.
Cela signifie que la plupart des composés capables d'induire la ferroptose dans les cellules cancéreuses peuvent également infliger le même sort à diverses cellules immunitaires, affaiblissant la capacité du système immunitaire à intervenir et à faire la guerre aux tumeurs mortelles.
Aujourd'hui, Li et une équipe de collaborateurs sur trois continents ont identifié une petite molécule prometteuse appelée N6F11, qui non seulement déclenche la mort cellulaire ferroptotique, mais provoque également sélectivement la dégradation de la glutathion peroxydase-4, également connue sous le nom de GPX4, un agent notoire. bloqueur de la ferroptose.
Li et ses collègues, qui se sont lancés dans une vaste chasse aux médicaments, criblant un grand nombre de composés pour trouver le N6F11 et ses propriétés uniques, disent qu'avec le N6F11 dans le mélange, la ferroptose peut être déclenchée et le GPX4 n'est plus en mesure d'empêcher ce phénomène spécialisé. forme de mort cellulaire due à l’annihilation de tumeurs. Encore plus révélateur, N6F11 a dégradé le GPX4 dans les cellules cancéreuses humaines du pancréas, de la vessie, du sein et du col de l'utérus sans affecter le GPX4 dans ce trio vital du système immunitaire : les cellules dendritiques, les lymphocytes T et les neutrophiles.
Li, ainsi que des collègues de l'Université Columbia à New York, de l'Université de Paris en France, d'une grande équipe du UT Southwestern Medical Center à Dallas et au-delà, ont également découvert que N6F11 ralentissait la croissance des tumeurs actives dans des modèles de souris inoculés avec des cellules cancéreuses du pancréas. Les animaux ont enduré le traitement sans effets secondaires graves, un effet que les auteurs ont lié à la capacité du N6F11 à stimuler les cellules T.
“La ferroptose dépendante de la peroxydation lipidique est devenue une stratégie émergente pour le traitement des tumeurs”, a ajouté Li. “Cependant, les stratégies actuelles induisent non seulement sélectivement la ferroptose dans les cellules malignes, mais déclenchent également simultanément la ferroptose dans les cellules immunitaires, ce qui peut compromettre l'immunité anti-tumorale.”
Li a expliqué dans Médecine translationnelle scientifique qu'en utilisant des tests In-Cell Western, combinés au dépistage massif de médicaments, l'équipe a pu identifier et confirmer le composé N6F11 en tant qu'inducteur de ferroptose.
“Une réponse immunitaire adaptative antitumorale efficace nécessite des cellules dendritiques qui présentent des antigènes associés à la tumeur aux lymphocytes T”, a poursuivi Li. “L'initiation de la réponse anticancéreuse par les cellules dendritiques dépend en grande partie de signaux immunitaires suffisants, en particulier des modèles moléculaires associés aux agents pathogènes et aux modèles moléculaires associés aux dommages.
“L'induction de la mort cellulaire immunogène par la chimiothérapie, la radiothérapie ou les thérapies ciblées peut déclencher une réponse immunitaire adaptative en exposant et en libérant une variété de modèles moléculaires associés aux dommages.
“Cependant, on ne sait pas quel type de mort cellulaire améliore de manière optimale l'immunogénicité des cellules tumorales”, a ajouté Li, notant que la mort cellulaire ferroptotique dépend d'une peroxydation lipidique illimitée plutôt que de la cascade d'événements enzymatiques associés à l'apoptose.
“En résumé, nous avons identifié une petite molécule, N6F11, qui induit la dégradation sélective de GPX4 dans les cellules malignes, mais non immunitaires”, a conclu Li. “Dans les petites tumeurs, la ferroptose induite par N6F11 (et) initie un puissant système immunitaire antitumoral.”
Plus d'information:
Jingbo Li et al, La dégradation de GPX4 spécifique à une tumeur améliore la réponse immunitaire antitumorale initiée par la ferroptose dans des modèles murins de cancer du pancréas, Médecine translationnelle scientifique (2023). DOI : 10.1126/scitranslmed.adg3049
© 2023 Réseau Science X
Citation: Une recherche massive de médicaments découvre une molécule infinitésimale qui tue les cancers tout en épargnant les cellules immunitaires (19 décembre 2023) récupéré le 19 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
