Analyser la façon dont les mutations du cancer interagissent peut améliorer les thérapies ciblées
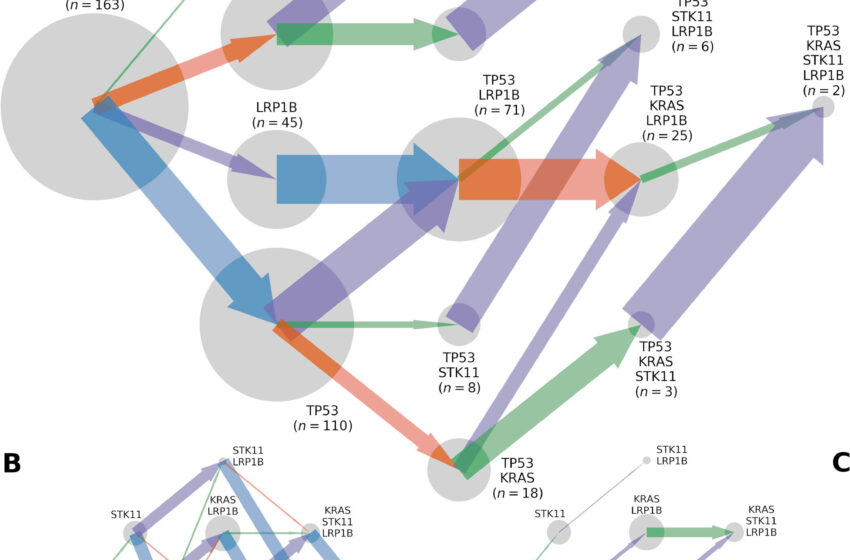
Trajectoires de l'évolution somatique par mutation de TP53, KRAS, LRP1B et STK11, déduites d'un total de 565 tumeurs d'adénocarcinome du poumon séquencées dans l'exome entier. Les génotypes somatiques (cercles gris ; les zones sont proportionnelles au n observé pour le génotype somatique) évoluent selon (A) des flux, (B) des taux de mutation et (C) des coefficients de sélection proportionnels à la largeur des flèches pointant vers un génotype somatique. à un autre, coloré par le gène dans lequel se produit la mutation (TP53, bleu ; KRAS, orange ; STK11, vert ; LRP1B : violet). Crédit: Biosciences mathématiques (2023). DOI : 10.1016/j.mbs.2023.109091
Le cancer survient lorsque de multiples mutations entraînent une croissance cellulaire incessante et inappropriée. Mais ces mutations n’agissent pas de manière isolée. Au lieu de cela, les mutations peuvent s’influencer mutuellement de manière à affecter l’évolution du cancer. Les chercheurs ont longtemps eu du mal à comprendre ces interactions, souvent en formulant des hypothèses qui simplifiaient à l’excès la réalité complexe.
Une méthode neuve de l'École de Yale de la Santé Publique (YSPH) offre une manière d'analyser comment les mutations interagissent les unes avec les autres pour modifier le développement des tumeurs. L’innovation devrait permettre de développer plus facilement des thérapies ciblées qui anticipent l’évolution d’un cancer, puis le coincent et l’éradiquent.
“Nous pouvons désormais caractériser où se situe le cancer sur sa trajectoire génétique chez un patient donné”, a déclaré l'auteur principal Jeffrey P. Townsend, professeur Elihu de biostatistique à la Yale School of Public Health et professeur d'écologie et de biologie évolutive à Yale. “Ces informations peuvent être très utiles pour déterminer les traitements appropriés, d'autant plus que nous obtenons de plus en plus d'options pour un traitement de précision des tumeurs.”
Les résultats sont publiés dans Biosciences mathématiques.
Quelle part de blâme attribuer à chaque mutation
Pour devenir cancéreuses, les cellules subissent une mutation et développent des caractéristiques appelées caractéristiques du cancer. Ces caractéristiques incluent la capacité à générer des signaux de croissance ou à ignorer les signaux d’arrêt de la croissance, à métastaser, à générer de nouveaux vaisseaux sanguins pour servir la ou les tumeurs, à esquiver les cellules immunitaires qui peuvent détecter et tuer une cellule aberrante, etc. Les cellules cancéreuses peuvent muter de diverses manières pour acquérir ces caractéristiques. Autrefois cellule cancéreuse, elle continue d’évoluer.
Cette adaptation continue à leur environnement rend le cancer difficile à traiter de manière ciblée. Un médicament ciblé crée une pression évolutive : les cellules qui y survivent en viennent rapidement à prédominer dans la tumeur, rendant finalement ce médicament inefficace. Un moyen de prédire quelles mutations sont susceptibles de se produire ensuite pourrait aider les cliniciens à trouver des moyens de prévenir la résistance.
Il y a quelques années, Townsend et ses collègues ont conçu un moyen d'estimer l'importance de chaque mutation dans un cancer en examinant la fréquence de chaque mutation individuelle dans un grand nombre de tumeurs ainsi que la vitesse sous-jacente à laquelle cette mutation apparaît.
“C'était une avancée majeure, car avant cela, tout le monde qualifiait les mutations de” cancérigènes “ou non, mais ne quantifiait pas la contribution de chaque mutation”, a déclaré Townsend, qui est également affilié au programme de biologie computationnelle et de bioinformatique de Yale.
Les cancers présentent de multiples mutations. L'étape suivante consistait à caractériser non seulement l'effet moyen de chaque mutation, mais également la manière dont chacune interagit avec la suivante qui se produit.
Le terme désignant ces interactions est épistasie : c’est-à-dire la façon dont une mutation affecte la mesure dans laquelle une autre mutation permet à un cancer de se développer et de survivre. Démêler l’épistasie est complexe, surtout si l’on considère les relations entre trois mutations ou plus.
Pour le projet actuel, Townsend a commencé par dériver une approche mathématique pour estimer l’épistasie pour des paires de mutations ponctuelles. Il a ensuite fait équipe avec Jorge Alfaro-Murillo, chercheur associé en biostatistique à l'YSPH, qui est le premier auteur de l'étude.
Alfaro-Murillo a développé une approche mathématique qui, avec suffisamment de données, fournira des estimations des interactions épistatiques entre trois, quatre mutations, voire plus.
L’ordre des mutations est important
Les chercheurs ont remarqué depuis longtemps que certaines mutations semblent toujours coexister dans un cancer donné, tandis que d’autres semblent s’exclure mutuellement. Pour cette raison, de nombreuses études antérieures ont supposé que certaines mutations fonctionnent ensemble ou s’opposent les unes aux autres.
Mais ce n’est pas nécessairement le cas, car toutes les cooccurrences ne sont pas de véritables interactions biologiques. Par exemple, certaines pourraient se produire parce qu’une certaine exposition, comme la fumée de tabac, tend à entraîner des mutations caractéristiques, chacune apparaissant indépendamment en raison de la fumée elle-même.
“Il existe des tonnes d'approches pour examiner l'exclusivité mutuelle et la cooccurrence et essayer de déterminer la fréquence à laquelle elles surviennent dans des ensembles de tumeurs. Mais l'exclusivité mutuelle et la cooccurrence ne sont tout simplement pas le meilleur moyen de déterminer l'exclusivité mutuelle et la cooccurrence. réponse”, a déclaré Townsend. “Notre méthode donne une meilleure réponse à la question de savoir quels gènes interagissent.”
En plus de tenir compte des taux de mutation sous-jacents, “cela le fait en partie en tenant compte de l'ordre dans lequel les mutations se produisent”, a expliqué Alfaro-Murillo.
Par exemple, disons que le travail du gène A consiste à provoquer l’autodestruction d’une cellule dangereusement mutée, tandis que le travail du gène B consiste à provoquer la multiplication d’une cellule.
Si une cellule développe d’abord une mutation dans le gène B, alors un gène A normal assurera la mort de la cellule avant qu’elle ne se divise de manière incontrôlable. Mais si le gène A mute en premier, suivi du gène B, la cellule peut survivre et commencer à se multiplier. L’ordre compte.
“Si la première mutation A se produit, alors la mutation B, qui pourrait être plus importante que la mutation B précédant A”, a déclaré Alfaro-Murillo. “C'est une différence majeure par rapport au simple examen de l'exclusivité mutuelle.”
Traduire les résultats dans les soins contre le cancer
Dans une limitation importante, les auteurs ont considéré uniquement les tumeurs qui n’avaient pas été exposées à des traitements. Ils prévoient ensuite d'examiner les tumeurs répondant au traitement, ainsi que d'examiner au-delà des mutations ponctuelles et de prendre en compte les mutations qui entraînent des changements plus importants, tels que des modifications du nombre de copies dans le génome ou des altérations chromosomiques. Les altérations du nombre de copies, également connues sous le nom de CNA, sont des modifications somatiques de la structure chromosomique qui entraînent un gain ou une perte de copies de sections d'ADN et sont répandues dans de nombreux types de cancer.
Ces méthodes analytiques devraient contribuer à rendre plus efficaces les essais sur le cancer et, à terme, les traitements impliquant plusieurs médicaments anticancéreux.
“Si votre tumeur présente une certaine composition de mutations et si vous savez qu'un traitement augmente la probabilité que vous obteniez certaines mutations, alors s'il existe des médicaments ciblés pour ces mutations, vous pourriez peut-être les appliquer immédiatement”, a déclaré Alfaro-Murillo. dit. “Si vous pouvez voir ce qui est le plus susceptible de se produire ensuite, alors vous pouvez vous y préparer.”
Plus d'information:
Jorge A. Alfaro-Murillo et al, Effets épistatiques par paires et d'ordre supérieur parmi les mutations du cancer somatique à travers l'oncogenèse, Biosciences mathématiques (2023). DOI : 10.1016/j.mbs.2023.109091
Fourni par l'Université de Yale
Citation: Analyser la façon dont les mutations cancéreuses interagissent peut améliorer les thérapies ciblées (2 janvier 2024) récupéré le 2 janvier 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
