Une étude révèle comment une enzyme fait du stop sur une autre pour reconnaître l’ARNt
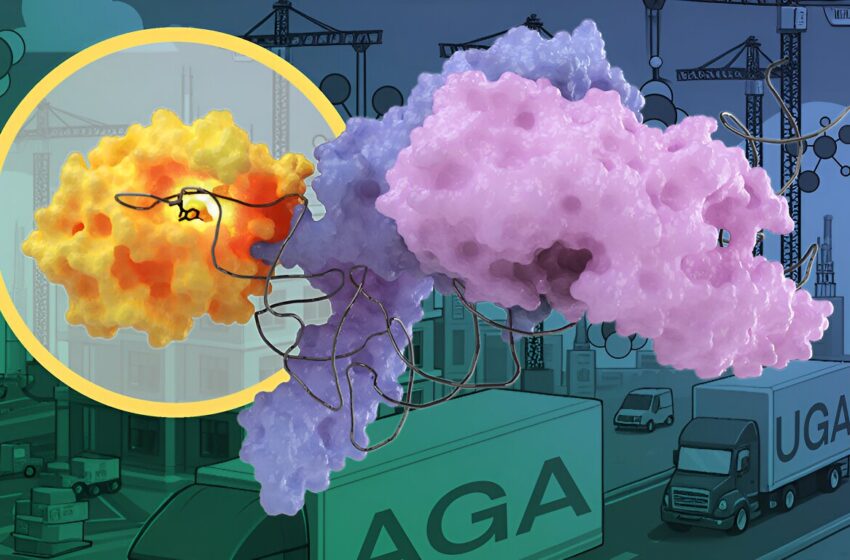
Une coopération inédite entre deux enzymes aide la cellule à construire de nouvelles protéines avec plus de précision. L’enzyme de modification de l’ARNt METTL6 (en orange) coopère avec la sérine ARNt synthétase (dans les tons lilas) pour sélectionner les ARNt de la sérine (ruban noir) à partir du pool cellulaire d’ARNt – des « camions de livraison » moléculaires transportant des éléments constitutifs de protéines. Crédit : Isabel Romero Calvo/EMBL
Imaginez votre corps comme une usine hautement organisée où les travailleurs assemblent sans relâche des protéines 24 heures sur 24. Ces protéines sont les machines et les échafaudages qui composent votre corps et sont essentielles à diverses fonctions. Dans cette usine, des camions de livraison spéciaux appelés transfert d’ARN (ARNt) livrent des acides aminés – les éléments constitutifs cruciaux des protéines – à la machinerie de fabrication des protéines – les ribosomes.
Le groupe Kowalinski de l’EMBL Grenoble a utilisé ici une combinaison de méthodes de biologie structurale pour apporter un nouvel éclairage sur le processus qui garantit que ces camions de livraison d’ARNt sont optimisés pour leurs tâches. Les résultats sont publiés dans la revue Nature Biologie structurale et moléculaire.
L’équipe a étudié les enzymes de modification de l’ARNt, un type de travailleurs moléculaires spécialisés, qui peuvent « personnaliser » ces camions de livraison d’ARNt. Ils apportent des modifications ou des ajouts spécifiques à la structure de l’ARNt, ce qui améliore l’efficacité et la précision du processus de création de protéines. Cela garantit que les camions d’ARNt sont optimisés et adaptés à leurs tâches respectives, conduisant à une production de protéines plus fiable et plus précise.
Étant donné que toutes les molécules d’ARNt se ressemblent beaucoup, mais que les enzymes de modification de l’ARNt ne fonctionnent qu’avec des types spécifiques d’ARNt, la question se pose : comment les enzymes de modification sélectionnent-elles avec précision les molécules d’ARNt spécifiques à modifier et s’assurent qu’elles ne choisissent pas par erreur les mauvaises ? ?
Pour répondre à cette question, le groupe Kowalinski a mené des expériences qui ont révélé comment une telle enzyme de modification de l’ARNt, appelée METTL6, sélectionne sa cible spécifique d’ARNt.
Lorsque les scientifiques souhaitent observer les moindres détails des protéines, ils peuvent utiliser une technique puissante appelée cryomicroscopie électronique. Ici, les scientifiques congèlent d’abord rapidement la protéine, aidant ainsi à la capturer dans sa forme 3D naturelle, sans aucune distorsion. Ensuite, ils utilisent un faisceau d’électrons qui crée, comme un projecteur, des ombres qui reflètent la structure 3D de la protéine.
“Nous utilisons ces ombres pour calculer la forme et la structure de la protéine”, a déclaré Luciano Dolce, postdoctorant impliqué dans l’étude. “Nous avons utilisé cette technique pour révéler la structure de METTL6 ainsi que son ARNt cible.”
Dans le cas de l’enzyme de modification de l’ARNt METTL6, les chercheurs ont découvert qu’elle n’agit pas seule, mais interagit avec une autre enzyme, une « ARNt synthétase ».
Dans l’analogie ci-dessus, les synthétases d’ARNt sont les travailleurs chargés de charger les véhicules de livraison d’ARNt et de garantir que les bons acides aminés sont chargés sur ces camions. Chaque camion de livraison d’ARNt porte un code ou un modèle spécifique qui correspond à un code sur le chantier de construction. Les synthétases d’ARNt sont des enzymes très intelligentes qui peuvent lire le code nucléotidique des camions d’ARNt, puis trouver et charger l’acide aminé correct qui correspond au code.
Les scientifiques ont découvert que l’enzyme de modification de l’ARNt METTL6, à elle seule, n’est pas particulièrement spécifique et n’est pas très efficace pour faire son travail. Au lieu de cela, METTL6 prend la main de son amie intelligente : la sérine ARNt synthétase. Cette synthétase d’ARNt se lie spécifiquement aux ARNt qui portent le code d’un acide aminé appelé sérine.
Lorsque l’ARNt sérine est lié à l’enzyme sérine ARNt synthétase, il est beaucoup plus facile de le distinguer des autres ARNt. Vous pourriez considérer la sérine ARNt synthétase comme un ami très intelligent qui aide METTL6 à déterminer quel ARNt modifier. Les auteurs de l’étude pensent que cette amitié est le premier exemple connu d’une enzyme modificatrice d’ARNt utilisant une synthétase d’ARNt comme facteur de reconnaissance.
Cette découverte va bien au-delà de la simple compréhension de la structure du complexe METTL6-sérine ARNt synthétase lié à l’ARNt ; c’est comme découvrir un nouvel outil puissant pour fabriquer de meilleurs médicaments. Ceci est particulièrement important puisque METTL6 est très abondant dans les échantillons de tumeurs de patients atteints de cancer, par exemple dans certains cancers du sein et du foie.
Des études sur des cultures cellulaires et sur des souris suggèrent que le ralentissement de METTL6 pourrait aider à réduire la croissance du cancer. Les nouvelles découvertes du groupe Kowalinski montrent comment fonctionne METTL6 et comment il reconnaît l’ARNt. Cela permettra de concevoir des médicaments précis pour ralentir la croissance tumorale, ce qui pourrait devenir une stratégie plus intelligente dans la lutte en cours contre les maladies, une stratégie qui découle de la compréhension du fonctionnement interne de la machinerie moléculaire du corps.
Plus d’information:
Philipp Throll et al, Base structurelle de la reconnaissance de l’ARNt par l’ARN m3C méthyltransférase METTL6 en complexe avec la séryl-ARNt synthétase SerRS, Nature Biologie structurale et moléculaire (2024). DOI : 10.1038/s41594-024-01341-3
Fourni par le Laboratoire européen de biologie moléculaire
Citation:Une étude révèle comment une enzyme s’associe à une autre pour reconnaître l’ARNt (2024, 25 juin) récupéré le 25 juin 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
