Une étude élucide le mécanisme à l’origine de la fibrose cardiaque, ouvrant la voie à de nouveaux traitements contre l’insuffisance cardiaque
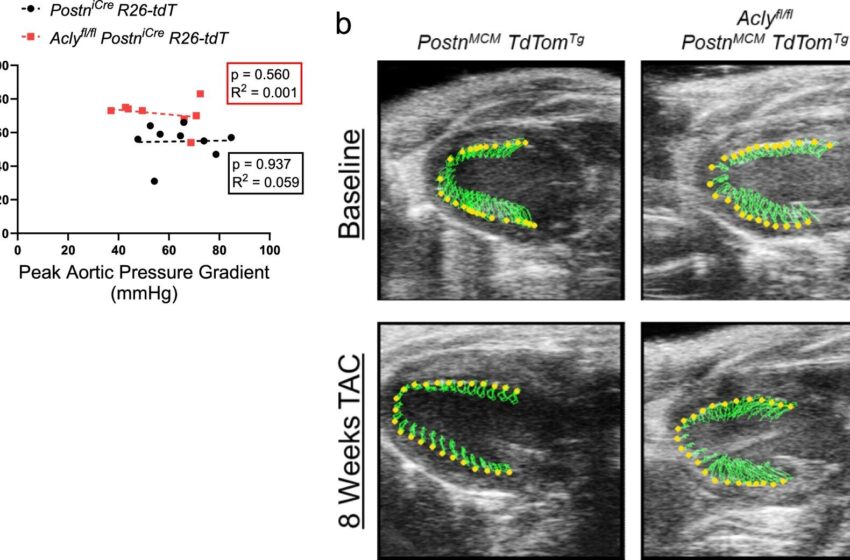
Gradients de pression aortique et suivi des taches en mode B sur des souris transgéniques. Crédit : Recherche cardiovasculaire sur la nature (2024). DOI: 10.1038/s44161-024-00502-3
Les maladies cardiovasculaires se terminent souvent par une insuffisance cardiaque, dont l’une des caractéristiques est la fibrose, une forme de cicatrisation des tissus. La fibrose cardiaque répare initialement les tissus cardiaques endommagés, mais elle peut rapidement devenir excessive et pathologique. L’identification des mécanismes à l’origine de la fibrose est un point central de la recherche cardiovasculaire, et des scientifiques de la Lewis Katz School of Medicine de l’Université Temple ont désormais découvert un mécanisme génétique essentiel à l’origine de ce processus – et ils ont identifié une nouvelle cible pour l’inverser.
« Dans la fibrose pathologique, les fibroblastes résidents dans le cœur qui sont activés par une lésion tissulaire se différencient en myofibroblastes qui produisent et sécrètent ensuite une matrice extracellulaire excessive », a expliqué John W. Elrod, Ph.D., directeur du Aging + Cardiovascular Discovery Center (ACDC) et professeur de sciences cardiovasculaires à la Katz School of Medicine, et chercheur principal de la nouvelle étude.
« L’activation des fibroblastes dépend souvent du facteur de croissance transformant β (TGFβ), et nous montrons maintenant pour la première fois que le TGFβ augmente l’enzyme ATP-citrate lyase (ACLY), qui se localise dans le noyau cellulaire et interagit à des sites spécifiques sur les gènes pour stimuler et maintenir épigénétiquement la fibrose. »
L’équipe du Dr Elrod a également découvert que l’inhibition de l’ACLY empêche la formation de myofibroblastes et l’activation des sites épigénétiques. Cette découverte fait de l’ACLY une nouvelle cible thérapeutique pour l’inversion de la fibrose. L’équipe a décrit ses découvertes dans un article publié en ligne dans la revue Recherche cardiovasculaire sur la nature.
Les nouveaux travaux s’appuient sur des observations antérieures du laboratoire du Dr Elrod, en particulier sur leur découverte antérieure d’une voie de signalisation qui favorise la formation de myofibroblastes via la déméthylation des histones. La déméthylation des histones est une modification épigénétique impliquée dans la transcription des gènes et les processus connexes qui régulent le flux d’informations génétiques dans les cellules. Les recherches antérieures de l’équipe ont également démontré que l’inhibition d’une voie métabolique connue sous le nom de glutaminolyse peut inverser la fibrose médiée par les myofibroblastes de manière dépendante de l’épigénétique.
L’ACLY est un élément clé des dernières recherches du Dr Elrod et de ses collègues, en raison du lien entre la glutaminolyse, les taux de métabolites et la biosynthèse de l’acétyl-CoA. L’ACLY est également connue pour soutenir l’acétylation des histones, qui influence les processus qui déterminent le destin cellulaire. Dans la nouvelle étude, l’équipe du Dr Elrod, dirigée par Michael P. Lazaropoulos, étudiant diplômé en médecine et en doctorat, a cherché à mieux comprendre l’implication de l’ACLY et, plus spécifiquement, le rôle de l’acétylation des histones dans la régulation du destin des myofibroblastes.

L’activité nucléaire de l’ACLY est essentielle à l’activation des myofibroblastes dépendante du TGFβ. Crédit : Recherche cardiovasculaire sur la nature (2024). DOI: 10.1038/s44161-024-00502-3
Dans des expériences initiales réalisées sur des fibroblastes cardiaques isolés de souris, les chercheurs ont démontré que l’ACLY est nécessaire à la différenciation des myofibroblastes et que son inhibition inverse le phénotype pro-fibrotique des myofibroblastes, ramenant les cellules à un état moins pathogène.
En utilisant un nouveau système génétique permettant la suppression simultanée de gènes et le suivi de protéines, ils ont ensuite montré que l’ACLY se déplace vers le noyau cellulaire, où il interagit avec un facteur de transcription appelé SMAD. Aidée par SMAD, l’ACLY est dirigée vers des endroits du génome où son implication dans l’acétylation des histones facilite la fibrose.
« Nous avons découvert que la liaison de l’ACLY au SMAD permet à l’ACLY de se localiser dans des locus génétiques spécifiques, où il verrouille ensuite la programmation génétique qui favorise la formation de myofibroblastes et un phénotype fibrotique », a expliqué le Dr Elrod.
L’équipe du Dr Elrod a également montré que l’inhibition de l’ACLY inverse le destin des myofibroblastes, permettant aux cellules de revenir à un phénotype non pathologique. Cela a été démontré sur des fibroblastes cardiaques de souris et sur des fibroblastes cardiaques isolés de patients atteints d’insuffisance cardiaque humaine. L’ACLY a été inhibée expérimentalement de deux façons, notamment par une intervention pharmacologique et par une perturbation génétique.
« Grâce à ces observations, nous pouvons affirmer avec certitude que les mécanismes épigénétiques impliquant l’acétylation sont essentiels au maintien du processus fibrotique dans les cellules cardiaques », a déclaré le Dr Elrod. « Nous disposons désormais également d’une cible, l’ACLY, pour inverser la fibrose, sur la base de nos études sur des cellules animales et des cellules de patients humains. »
Le Dr Elrod espère maintenant accroître l’impact translationnel des nouvelles découvertes en étudiant des agents pharmacologiques capables d’inhiber l’ACLY. « L’un des agents que nous avons utilisé dans nos expériences a été étudié dans le cadre d’essais cliniques pour d’autres applications », a-t-il noté. En plus d’explorer des pistes thérapeutiques, son équipe prévoit également d’étendre ses découvertes à d’autres maladies impliquant une fibrose pathologique.
Plus d’information:
Michael P. Lazaropoulos et al., L’ATP-citrate lyase nucléaire régule l’activation et le maintien du programme génétique des myofibroblastes, dépendants de la chromatine, Recherche cardiovasculaire sur la nature (2024). DOI: 10.1038/s44161-024-00502-3
Fourni par l’Université Temple
Citation:Une étude élucide le mécanisme à l’origine de la fibrose cardiaque, ouvrant la voie à de nouveaux traitements contre l’insuffisance cardiaque (2024, 10 juillet) récupéré le 10 juillet 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
