
Comment les protéines gardiennes passent du statut d’inhibiteurs à celui de promoteurs du cancer
Cellules contenant des protéines p53 cancérigènes (rouge) ; le matériel génétique des noyaux cellulaires est en bleu. À gauche : en présence d’un chaperon DNAJA2 régulier, la structure des protéines p53 est stabilisée, de sorte qu’elles ne se lient pas entre elles et restent donc dispersées dans la cellule. À droite : en revanche, en présence d’une variante DNAJA2 sans « épingle à cheveux », les protéines p53 cancérigènes forment des amas (points rouges) que la cellule peut reconnaître et détruire. Crédit : Institut Weizmann des Sciences
« Qui surveillera les surveillants ? » demandait le poète romain Juvénal au premier siècle de notre ère. La nature se pose cette même question depuis bien plus longtemps. Le corps humain contient des protéines qui sont conçues pour nous protéger des tumeurs cancéreuses.
Comme la plupart des protéines, pour remplir correctement leur rôle, ces « gardiens » doivent se replier dans une structure tridimensionnelle spécifique, et ils ont souvent besoin d’un coup de main pour y parvenir. Ces gardiens sont donc surveillés par des protéines chaperonnes, des molécules qui veillent à ce que les protéines soient correctement repliées pour qu’elles puissent fonctionner comme elles le devraient.
Parfois, des mutations génétiques dans les protéines gardiennes peuvent transformer ces dernières d’inhibiteurs en promoteurs du cancer. Incapables de déceler ce changement, les chaperons qui les protègent leur fournissent malheureusement la même assistance qu’aux protéines normales.
Dans une nouvelle étude, le Dr Rina Rosenzweig et son équipe de recherche de l’Institut Weizmann des sciences ont découvert un mécanisme par lequel les chaperons protègent une protéine présentant une mutation cancéreuse. Leurs résultats, publiés dans Cellule moléculairepourrait ouvrir la voie au développement de nouveaux traitements ciblés contre le cancer.
L’une des familles de protéines chaperonnes les plus courantes est la famille des protéines du domaine J (JDP). Au cours des dernières décennies, les chercheurs ont découvert qu’il existe environ 50 représentants différents dans le corps humain.
Leurs fonctions consistent notamment à identifier les protéines qui ne se sont pas repliées correctement ou dont la structure s’est désintégrée, et à les envoyer se replier à l’aide d’autres chaperons. Parmi leurs autres tâches, les membres de la famille JDP participent au repliement de la protéine p53, connue comme la « gardienne du génome ».
Dans sa forme habituelle, ce gardien du génome inhibe les croissances cancéreuses, mais de minuscules changements génétiques qui remplacent l’un de ses acides aminés constitutifs peuvent l’amener à favoriser le cancer. Des études antérieures ont montré que les gardiens du gardien du génome, c’est-à-dire les chaperons, assurent la protection non seulement du p53 qui fonctionne correctement, mais aussi de sa version cancéreuse.
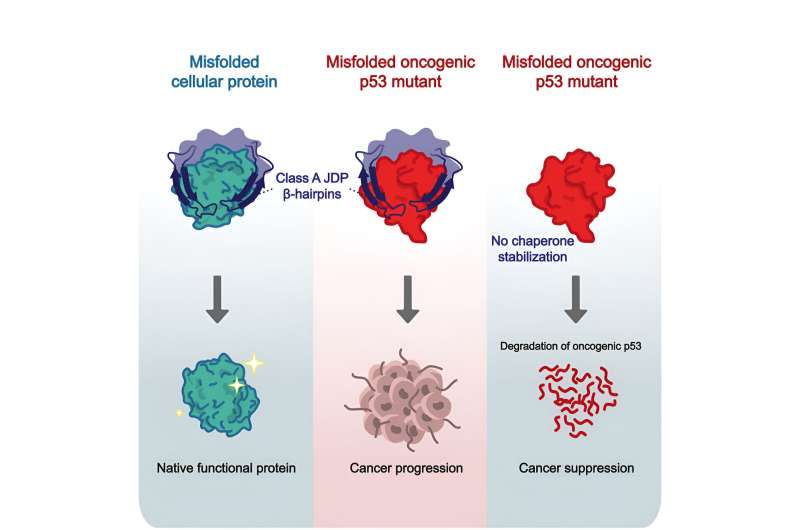
Les chaperons stabilisent la structure instable des protéines cancéreuses et les empêchent d’adhérer les unes aux autres et de former des agrégats désordonnés que les cellules repéreraient et démantèleraient normalement, sans cette aide même.
Il semble donc que les chaperons pourraient être une bonne cible pour le développement de nouvelles thérapies contre le cancer. Cependant, comme ils aident une large gamme de protéines dans la cellule, endommager les chaperons pourrait entraîner de graves dommages secondaires.
Des chercheurs du laboratoire de Rosenzweig au département de biologie chimique et structurelle, dirigé par le Dr Guy Zoltsman, avec la participation de Miriam Kuchersky et du Dr Ofrah Faust, ont postulé que l’étude des membres de la famille JDP qui fournissent une assistance aux versions cancéreuses de la protéine p53 pourrait découvrir une nouvelle cible pour un traitement ciblé du cancer.
Crédit: Cellule moléculaire (2024). DOI: 10.1016/j.molcel.2024.02.018
La première étape a consisté à identifier précisément les membres de la famille qui aident la protéine p53 muté et cancéreuse. Pour ce faire, les chercheurs ont examiné quatre groupes de protéines de la famille JDP dont on a démontré qu’elles avaient un impact sur la progression du cancer. Ces expériences ont révélé que seules les protéines chaperonnes de classe A, en particulier une protéine appelée DNAJA2, aidaient la protéine p53 muté.
Ces résultats ont également été vérifiés dans les cellules cancéreuses, grâce à un projet de recherche conjoint avec le laboratoire du professeur Bernd Bukau du Centre allemand de recherche sur le cancer (DKFZ) à Heidelberg. Mais comment DNAJA2 identifie-t-il et protège-t-il la protéine cancéreuse p53 ?
En utilisant une technologie de pointe de résonance magnétique nucléaire (RMN) à l’Institut Weizmann Clore pour l’imagerie et la spectroscopie par résonance magnétique à haut champ, les chercheurs ont réussi à découvrir le mécanisme d’action de DNAJA2.
La plupart des protéines d’une cellule sont créées sous forme de chaînes moléculaires qui se replient dans une structure tridimensionnelle dans laquelle les composants hydrophiles sont situés à l’extérieur de la structure de la protéine, face à l’environnement liquide de la cellule, tandis que les composants hydrofuges sont situés dans la partie interne de la protéine.
Dans des circonstances normales, en identifiant les zones hydrofuges qui sont devenues exposées à la surface de la protéine, les chaperons peuvent reconnaître une protéine qui ne s’est pas repliée correctement ou qui a perdu sa forme tridimensionnelle normale.
« Contrairement aux autres chaperons, DNAJA2 se lie à p53 lorsque celui-ci est presque entièrement replié », explique Rosenzweig. « Il s’avère qu’il est capable d’identifier des protéines dans lesquelles la structure tridimensionnelle vient juste de commencer à se défaire, bien avant que des zones internes entières ne soient exposées. »
Grâce à la RMN, les chercheurs ont pu analyser l’interaction entre DNAJA2 et la protéine p53 jusqu’au niveau des atomes individuels. Cela a révélé que des sections en forme d’épingle à cheveux de la protéine chaperonne – appelées ainsi épingles à cheveux β (épingles à cheveux bêta) – se fixent à des zones ressemblant à des accordéons (appelées feuillets β) au cœur de la protéine cible.
La structure des feuillets β est renforcée par des liaisons hydrogène, qui restent stables tout au long de la vie fonctionnelle de la protéine. Cependant, lorsque ces liaisons se détachent, comme c’est le cas dans la version cancéreuse du gardien du génome, elles augmentent le risque que la protéine adhère à d’autres protéines.
C’est là que les épingles à cheveux entrent en jeu : elles se lient à ces zones desserrées, les stabilisent et leur donnent le temps de reconstruire les liaisons hydrogène. Cette protection accordée aux protéines cancéreuses empêche la cellule de les identifier et de les décomposer.
Lorsque les chercheurs ont supprimé la recette de l’épingle à cheveux du code génétique des chaperons, ils ont découvert que les chaperons restaient fonctionnels et que la suppression endommageait uniquement leur liaison aux protéines particulièrement riches en feuillets d’accordéon, comme p53.
« Étant donné que l’activité de l’épingle à cheveux est si concentrée, il semble que nous devrions être en mesure de développer des traitements contre le cancer en ciblant des régions spécifiques de chaperons spécifiques, sans causer de dommages significatifs au fonctionnement des cellules du corps », explique Rosenzweig. « Notre étude présente la cible potentielle de tels traitements, qui réduirait l’activité de soutien du cancer de DNAJA2. »
Plus d’information:
Guy Zoltsman et al, Un mécanisme de chaperonnage unique dans les JDP de classe A reconnaît et stabilise le mutant p53, Cellule moléculaire (2024). DOI: 10.1016/j.molcel.2024.02.018
Fourni par l’Institut Weizmann des Sciences
Citation:Comment les protéines gardiennes passent du statut d’inhibiteurs à celui de promoteurs du cancer (2024, 12 juillet) récupéré le 12 juillet 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
