La disposition spatiale de trois cellules immunitaires est essentielle pour attaquer les tumeurs, selon une étude
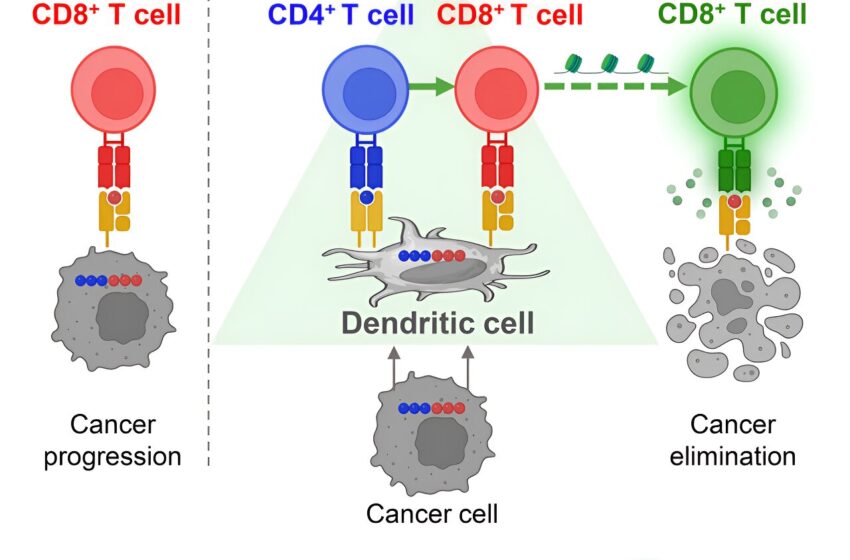
Résumé graphique. Crédit : Cellule cancéreuse (2024). DOI: 10.1016/j.ccell.2024.05.025
Il y a un fait frustrant à propos des immunothérapies actuelles contre le cancer. Si parfois elles fonctionnent à merveille – éliminant complètement ou réduisant considérablement le cancer chez certains patients –, d’autres fois, elles ne fonctionnent pas du tout. C’est un mystère.
Les scientifiques ont avancé plusieurs hypothèses pour expliquer cette disparité. Peut-être s’agit-il du nombre de mutations présentes dans une tumeur, un plus grand nombre de mutations entraînant de meilleures réponses. Ou peut-être s’agit-il de l’environnement tissulaire entourant la tumeur, certains environnements favorisant et d’autres inhibant des réponses immunitaires efficaces. Mais jusqu’à présent, aucune de ces explications ne s’est avérée définitive ou applicable dans tous les cas.
Des chercheurs du Memorial Sloan Kettering Cancer Center (MSK) et du Baylor College of Medicine à Houston, au Texas, pensent désormais avoir une meilleure explication.
« Il s’avère que pour que les cellules immunitaires puissent tuer efficacement les cellules d’une tumeur, elles doivent adopter une configuration spatiale spécifique », explique Andrea Schietinger, Ph. D., immunologiste tumoral et membre du programme d’immunologie de l’Institut Sloan Kettering du MSK. « Elles doivent former une triade. »
Triade, c’est-à-dire trois cellules. Mais trois cellules quelconques ne suffiront pas. Ce dont on a besoin, explique-t-elle, c’est de trois cellules immunitaires différentes qui collaborent toutes ensemble en même temps et au même endroit : une cellule dendritique, une cellule T cytotoxique (« tueuse ») et une cellule T auxiliaire.
Ces cellules ne sont ni rares ni inhabituelles, d’un point de vue immunologique. Elles sont les acteurs standards décrits dans tous les manuels d’immunologie. Mais jusqu’à présent, personne ne savait que ces cellules devaient être physiquement présentes ensemble dans les tumeurs pour générer une réponse immunitaire efficace contre les cellules cancéreuses.
La découverte, publiée dans la revue Cellule cancéreusea des implications thérapeutiques immédiates et pourrait modifier la façon dont les médecins administrent les immunothérapies.
À la recherche d’indices sur les raisons de l’échec d’une force de combat d’élite
Gabriel Espinosa-Carrasco, Ph.D., chercheur postdoctoral au laboratoire de Schietinger, est le premier auteur de ce nouvel article. Ce qui a éveillé la curiosité des Dr Schietinger et Espinosa-Carrasco à propos de cette ligne de recherche, ce sont les données abondantes – et franchement décourageantes – issues d’essais cliniques sur des thérapies adoptives à base de lymphocytes T.
Il s’agit de thérapies dans lesquelles les chercheurs prélèvent un échantillon de lymphocytes T cytotoxiques d’un patient, identifient ceux qui reconnaissent le cancer, puis multiplient ces cellules en milliards de copies en laboratoire et les réinjectent au patient. (Les scientifiques peuvent également concevoir des lymphocytes T en laboratoire pour reconnaître des cibles spécifiques, puis les multiplier et les injecter.)
L’approche semble logique ; elle devrait fonctionner, mais ce n’est souvent pas le cas.
« Comment est-il possible que nous puissions produire en laboratoire les lymphocytes T cytotoxiques les plus parfaits, administrer des milliards de ces cellules aux patients, et qu’ils ne parviennent toujours pas à éliminer le cancer ? », s’interroge le Dr Schietinger. « Il semble y avoir quelque chose de tellement fondamental que nous oublions ce dont les lymphocytes T cytotoxiques ont besoin pour tuer efficacement. »
Rétrospectivement, dit-elle, la réponse semble évidente.
Donner aux lymphocytes T le droit de tuer
Les scientifiques savent depuis longtemps que les lymphocytes T cytotoxiques n’agissent pas seuls. Ils ont besoin de l’aide de lymphocytes T auxiliaires pour s’armer et s’activer. « C’est une évidence », souligne le Dr Schietinger.
C’est pourquoi, comme elle l’explique, chaque protocole existant dans lequel les cellules T cytotoxiques sont activées et préparées pour une thérapie adoptive par cellules T ajoute des substances chimiques importantes produites par les cellules T auxiliaires. À ce stade, les cellules T cytotoxiques devraient être prêtes à combattre le cancer lorsqu’elles seront réinjectées dans le corps.
Mais que se passe-t-il si les lymphocytes T cytotoxiques ont besoin de l’aide des lymphocytes T auxiliaires non seulement pour s’armer et s’activer au début, mais aussi pour mener à bien leur mission de destruction ? « Les lymphocytes T cytotoxiques – comme James Bond – ont-ils besoin d’une licence pour tuer ? » s’est demandé le Dr Schietinger.
Pour le savoir, elle et son équipe ont conçu un modèle murin de cancer qu’elle pouvait traiter avec une forme de thérapie adoptive par lymphocytes T similaire à celles actuellement utilisées chez l’homme. Elle a mis en place deux situations contrastées. Dans un cas, elle a administré aux souris atteintes de cancer uniquement des lymphocytes T cytotoxiques. Dans l’autre cas, elle a administré aux souris à la fois des lymphocytes T cytotoxiques et des lymphocytes T auxiliaires. Les résultats ont été clairs et spectaculaires : seules les souris qui avaient reçu les deux types de lymphocytes T ont vu leurs tumeurs régresser.
« Cela signifie que le simple fait de mettre en marche la machinerie cytotoxique ne suffit pas à tuer la cellule ciblée », explique le Dr Schietinger. « Il faut lui donner l’autorisation de tuer la cellule ciblée. »
Les mécanismes de cette immunité sont devenus plus évidents lorsqu’ils ont observé les tissus tumoraux des souris au microscope. C’est alors qu’ils ont constaté que chez les souris qui avaient répondu au traitement, leurs cellules avaient formé les triades de cellules immunitaires caractéristiques. Les cellules étaient physiquement imbriquées les unes dans les autres. D’une certaine manière, explique le Dr Schietinger, cette disposition spatiale permet aux cellules T cytotoxiques de recevoir enfin le message : il est temps d’agir.
C’était une découverte intéressante et passionnante. Mais serait-elle valable au-delà du modèle de souris particulier qu’ils ont utilisé ?
De la souris à l’homme
Pour répondre à cette question, le Dr Schietinger et son équipe ont contacté leurs collègues du Baylor College of Medicine, les chirurgiens Hyun-Sung Lee, Ph. D., et Bryan M. Burt, Ph. D. Ce groupe disposait de données inédites sur un groupe de patients atteints de mésothéliome pleural, un type de cancer du poumon, qui avaient été traités par une forme d’immunothérapie appelée blocage des points de contrôle immunitaires. Au sein de ce groupe, certains patients avaient bien répondu au traitement, voyant leurs tumeurs rétrécir, tandis que d’autres non.
Lorsque les chirurgiens de Baylor ont examiné à nouveau les échantillons de tissus qu’ils avaient collectés dans le cadre de l’essai, ils ont découvert que les patients qui avaient répondu au traitement présentaient les triades caractéristiques de leurs tumeurs. Ceux qui n’avaient pas répondu au traitement n’en présentaient pas.
C’est une preuve assez convaincante que les triades immunitaires sont effectivement importantes, et pas seulement une coïncidence. Les trois types de cellules immunitaires interagissent de telle manière qu’elles constituent une force de combat plus puissante contre les cellules cancéreuses.
Implications cliniques des triades de cellules immunitaires
Quelles sont les implications de tout cela ? Tout d’abord, explique le Dr Schietinger, il est possible que ces triades puissent être utilisées comme biomarqueurs pour identifier les individus susceptibles de répondre à l’immunothérapie. Jusqu’à présent, les médecins ne disposent pas de bons biomarqueurs pour faire cette distinction.
Deuxièmement, les résultats suggèrent que les médecins devraient repenser la manière dont ils administrent les thérapies adoptives à base de lymphocytes T. Au lieu d’administrer principalement des lymphocytes T tueurs, peut-être devraient-ils également inclure des lymphocytes T auxiliaires ; et peut-être qu’un nombre beaucoup moins important de lymphocytes T tueurs suffirait s’il y avait également des lymphocytes T auxiliaires dans le mélange.
Enfin, les résultats ont des implications pour la conception de vaccins contre le cancer, où des fragments de protéines associées au cancer sont conçus pour stimuler les cellules T tueuses des patients.
L’équipe de la Dre Schietinger s’efforce de faire progresser la recherche dans toutes ces directions. Par exemple, un membre de son équipe, un bioingénieur, conçoit des outils pour connecter un lymphocyte T tueur à un lymphocyte T auxiliaire, afin de favoriser la formation d’une triade avec une cellule dendritique (le type de cellule responsable de la présentation de fragments de protéines cancéreuses aux lymphocytes T).
Ils expérimentent également de nouvelles formulations de vaccins contre le cancer et s’associent à d’autres leaders du domaine pour mener ces travaux jusqu’aux essais cliniques.
« Nos résultats montrent que ce n’est pas le nombre absolu de cellules qui compte, mais leur configuration spatiale », explique le Dr Schietinger. « Les trois types de cellules doivent être sur le champ de bataille ensemble, et notre prochain grand objectif est de développer des thérapies qui y parviennent. »
Plus d’information:
Gabriel Espinosa-Carrasco et al., Les triades immunitaires intratumorales sont nécessaires à l’élimination des tumeurs solides par immunothérapie, Cellule cancéreuse (2024). DOI: 10.1016/j.ccell.2024.05.025
Fourni par le Memorial Sloan Kettering Cancer Center
Citation:Mieux ensemble : la disposition spatiale de trois cellules immunitaires est essentielle pour attaquer les tumeurs, selon une étude (2024, 15 juillet) récupéré le 15 juillet 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
