Les gouttelettes de protéines ne sont probablement pas à l’origine de la maladie de Parkinson, selon une étude
Crédit: Sciences avancées (2024). DOI: 10.1002/advs.202308279
La séparation de phase liquide-liquide n’est pas un précurseur de la formation de fibrilles amyloïdes, une caractéristique pathologique de la maladie de Parkinson, montre une étude récente. Au contraire, la transformation de protéines en gouttelettes liquides pourrait aider à dissoudre les protéines agrégées. L’étude, publiée dans la revue Sciences avancéesapprofondit notre compréhension des maladies neurodégénératives liées à l’agrégation de protéines et pourrait aider à développer de nouvelles thérapies.
Ajoutez du vinaigre à l’huile et secouez : des gouttelettes d’huile se forment. Le concept de séparation de phase liquide-liquide est connu dans la vie quotidienne depuis des générations, mais son existence dans la cellule est devenue l’un des sujets les plus brûlants de la biologie.
Il y a quinze ans, on a découvert que les molécules de protéines pouvaient se condenser en gouttelettes, isolées du cytoplasme de la cellule sans membrane externe. Dans les embryons d’ascaris, les protéines et l’ARN formaient de minuscules gouttelettes qui aident à gérer le matériel génétique pendant les premiers stades de croissance.
Cette découverte a donné naissance à une nouvelle façon de penser la cellule. Optimisée par l’évolution, la séparation de phase liquide-liquide pourrait être hautement fonctionnelle. De telles gouttelettes pourraient permettre aux cellules de compartimenter les molécules et de réguler les réactions biochimiques.
Maintenant que les yeux sont ouverts à cette possibilité, les chercheurs les ont trouvés partout : dans le noyau, aidant à organiser l’ADN, formant des granules de stress pour protéger et réguler l’ARNm et aux extrémités des microtubules, agissant comme une colle moléculaire intelligente pour positionner le noyau pour la division cellulaire.
Outre leur importance fonctionnelle, les gouttelettes ont été impliquées dans certaines maladies. Dans le cas de maladies neurodégénératives caractérisées par la formation d’agrégats protéiques, comme la maladie d’Alzheimer et la maladie de Parkinson, on a supposé que les gouttelettes protéiques étaient un précurseur de l’agrégation protéique pathologique.
L’idée derrière cette théorie est que les gouttelettes peuvent concentrer certaines protéines, ce qui pourrait les pousser à s’agréger. De nombreuses observations confirment cette théorie, selon lesquelles certaines conditions telles que la concentration en sel ou le pH favorisent simultanément l’agrégation et la condensation des protéines. Cependant, il n’est pas encore prouvé si ces deux phénomènes sont liés, ni même de quelle manière.
Aujourd’hui, dans l’exploration la plus complète à ce jour de la relation entre l’agrégation et la séparation de phase liquide-liquide, une équipe de recherche dirigée par l’Institut Paul Scherrer PSI a découvert que la formation de gouttelettes ne provoque pas d’agrégation ; au contraire, elle peut en protéger.
Cinq cents conditions
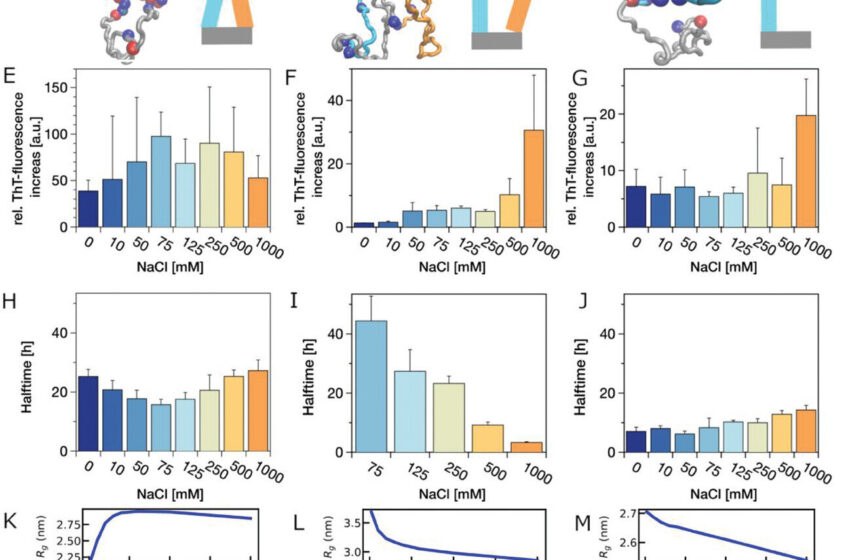
Les chercheurs ont étudié la protéine alpha-synucléine (ɑSyn), qui s’agglutine pour former les fibrilles amyloïdes qui conduisent finalement à la mort cellulaire chez les patients atteints de la maladie de Parkinson.
Pour déterminer le véritable lien entre l’agrégation et la formation de gouttelettes, les chercheurs ont étudié méthodiquement le comportement des protéines ɑSyn dans une grande variété de conditions : concentration en protéines, concentration en sel et présence de diverses concentrations d’agents de surpeuplement qui imitent l’environnement moléculaire complexe du cytoplasme. Chacun de ces éléments a été étudié à différentes valeurs de pH.
Au total, les chercheurs ont étudié plus de cinq cents conditions différentes. Pour chaque condition, ils ont suivi la progression de la formation ou de l’agrégation des gouttelettes pendant une période allant jusqu’à quatre mois, en prenant des images régulières au moyen d’un microscope optique.
Pour étudier ces nombreuses conditions, les chercheurs ont utilisé l’installation de cristallisation robotisée de la Source de Lumière Suisse SLS. Cette technique est généralement utilisée pour préparer des cristaux de protéines pour des expériences de cristallographie aux rayons X.
« Le fait de travailler dans des installations à grande échelle et aux côtés de scientifiques travaillant sur des lignes de faisceaux nous a permis d’aborder ce problème sous un angle différent », explique Rebecca Sternke-Hoffmann, chercheuse postdoctorale au PSI et première auteure de l’étude.
« Il est intéressant de noter que les cristallographes savent depuis très longtemps que les protéines peuvent former des gouttelettes. C’est simplement une autre chose qu’ils ont observée dans leur recherche du cristal parfait », ajoute Jinghui Luo, scientifique du PSI qui a dirigé l’étude.
Pour compléter cette histoire macroscopique, les chercheurs ont utilisé des mesures de diffusion des rayons X aux petits angles (SAXS) à la Source de Lumière Suisse SLS et ont effectué des simulations pour comprendre l’image microscopique.
Le vinaigre dans l’huile et le vinaigre dans le lait sont des procédés différents
Les expériences minutieuses ont révélé que les conditions qui donnent naissance à des gouttelettes stables ou à une agrégation de protéines ne sont pas les mêmes. Contrairement à la théorie conventionnelle selon laquelle les agrégats naissent à partir de gouttelettes, les chercheurs ont montré une formation indépendante de gouttelettes et d’agrégats dans αSyn dans diverses conditions de protéines, de sel et de surpeuplement.
Au cours de cette longue période d’étude, les chercheurs ont pu vérifier si les gouttelettes se transformaient réellement en agrégats. Réponse : ce n’est pas le cas, même après cent vingt jours. En effet, loin de favoriser l’agrégation en fibrilles, les gouttelettes semblent avoir l’effet inverse. Au cours d’incubations prolongées, des fibrilles jusque-là considérées comme irréversibles se transforment en gouttelettes.
« Cette observation suggère que les gouttelettes de liquide jouent un rôle fonctionnel dans la prévention de la formation d’agrégats solides dans des conditions spécifiques », explique Luo. Les connaissances actuelles sur la séparation de phase liquide-liquide dans la cellule l’identifient comme une caractéristique hautement évoluée associée à la fonctionnalité, tandis que l’agrégation, en particulier dans le cas de l’αSyn, est associée à la maladie.
« De ce point de vue, il serait quelque peu surprenant que les gouttelettes de protéines soient des précurseurs de l’agrégation de protéines », suggère-t-il.
Grâce aux mesures SAXS associées aux simulations et à l’analyse de séquences, les chercheurs ont pu comprendre les différences observées : l’agrégation se produit principalement en raison des interactions entre les queues des molécules de protéines individuelles, tandis que la séparation de phase liquide-liquide se produit en raison des interactions entre différentes molécules de protéines.
Pour relier cette découverte à l’analogie de l’huile et de l’eau : ajoutez du vinaigre à l’huile et l’huile forme des gouttelettes. Ajoutez du vinaigre au lait et des agrégats durs de protéines se forment. Bien que le vinaigre soit le coupable dans les deux cas, des processus très différents régissent l’agrégation et la formation de gouttelettes.
Une meilleure compréhension de l’interaction complexe entre l’agrégation des protéines et la séparation de phase liquide-liquide est pertinente non seulement pour la maladie de Parkinson, mais aussi pour d’autres maladies neurodégénératives caractérisées par l’agrégation des protéines, notamment la maladie d’Alzheimer, la maladie de Huntington et la maladie de Creutzfeldt-Jakob. Cela pourrait à son tour conduire à de nouveaux traitements.
Plus d’information:
Rebecca Sternke-Hoffmann et al., La séparation de phase et l’agrégation de l’α-synucléine divergent dans différentes conditions salines, Sciences avancées (2024). DOI: 10.1002/advs.202308279
Fourni par l’Institut Paul Scherrer
Citation:Les gouttelettes de protéines ne sont probablement pas à l’origine de la maladie de Parkinson, selon une étude (2024, 15 juillet) récupéré le 15 juillet 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
