Nouvel aperçu de la spectroscopie ultrarapide térahertz Stark
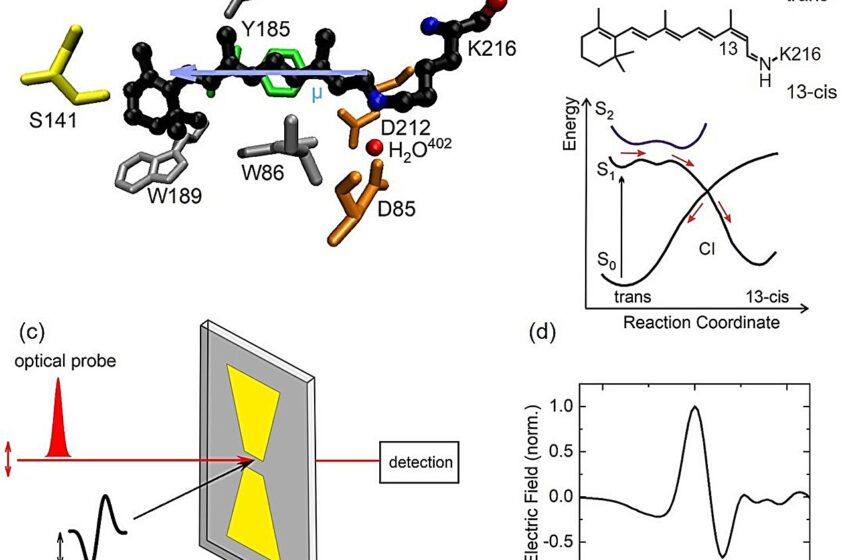
(a) Structure moléculaire de la base de Schiff rétinienne protonée dans la bactériorhodopsine (structure moléculaire noire) et sa poche de liaison dans la protéine, constituée d’acides aminés et d’une molécule d’eau intégrée. La flèche bleue indique le moment dipolaire électrique de la rétine. (b) Structure moléculaire des isomères trans et 13-cis de la base de Schiff rétinienne protonée et schéma des surfaces d’énergie potentielle électronique de l’état fondamental S0 et les états excités S1 et S2 le long de la coordonnée de réaction pour l’isomérisation. Le mélange du S1 et S2 états conduit à des minima de potentiel peu profonds dans les états excités avec un fort impact sur la dynamique photoinduite initiale. La réaction d’isomérisation se produit lors du franchissement de l’intersection conique (CI) des potentiels excités et fondamentaux. (c) Schéma de l’expérience THz Stark avec une forte impulsion de pompe THz et une impulsion de sonde optique. Le champ THz agissant sur l’échantillon est renforcé à l’aide d’une structure d’antenne métallique (structure jaune au-dessus de la couche grise de l’échantillon) et atteint une valeur de plusieurs mégavolts/cm. Le changement d’absorption induit par THz de l’échantillon est mesuré avec l’impulsion de la sonde transmise à travers l’espacement de l’antenne. (d) Champ électrique dépendant du temps de l’impulsion THz (1 ps = 10-12 s). Crédit : MBI/T. Elsaesser
La protéine membranaire bactériorhodopsine est une pompe à protons dans laquelle le transport des protons est initié par l’isomérisation induite par la lumière du chromophore rétinien. Les états quantiques moléculaires impliqués dans cette réaction ultrarapide ont maintenant été caractérisés en mesurant leur moment dipolaire électrique.
La nouvelle méthode de spectroscopie térahertz Stark révèle un mélange d’états excités électroniquement avec un impact direct sur le cheminement et la dynamique de la photoréaction.
La base de Schiff rétinienne protonée, le chromophore de la bactériorhodopsine, subit un changement ultrarapide de sa structure moléculaire lors de l’absorption de la lumière. La photoexcitation promeut le chromophore vers une plage particulière de sa surface d’énergie potentielle à l’état excité, à partir de laquelle la molécule excitée évolue le long d’une coordonnée de réaction jusqu’au point d’intersection des surfaces potentielles excitées et de l’état fondamental. Après cette propagation précoce à l’état excité, l’isomérisation se produit lors du passage de ce point de passage en l’espace d’environ 500 fs=5×10.-13 s après excitation.
Jusqu’à présent, la nature du potentiel d’état excité régissant la dynamique des réactions est restée controversée. Les modèles théoriques ont invoqué soit le premier état excité S1 seul ou un état quantique mixte avec une contribution du deuxième état excité S2.
Cette question appelle à de nouvelles connaissances expérimentales sur le caractère excité. Une quantité prometteuse à sonder est le moment dipolaire électrique de la rétine, qui est nettement différent dans l’état fondamental S.0 et les premier et deuxième états excités S1 et S2. Ainsi, une mesure du changement dipolaire lors de la photoexcitation devrait permettre de clarifier le caractère de l’état excité pertinent pour la dynamique précoce de la bactériorhodopsine.
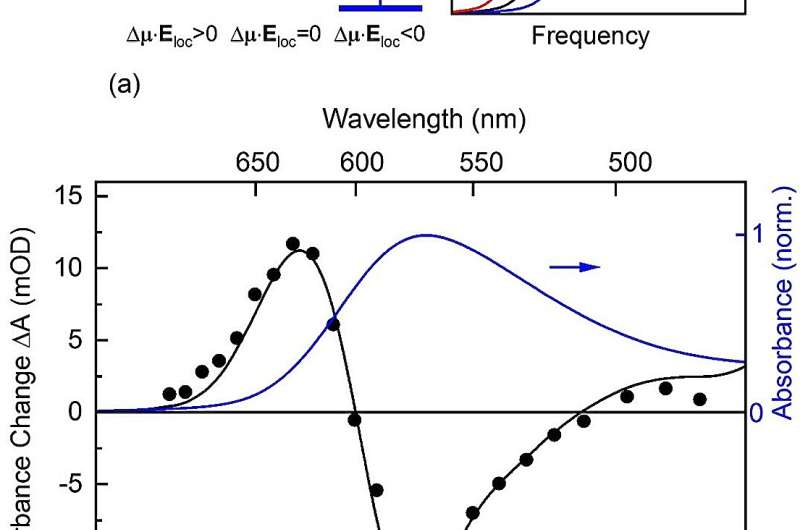
(a) Schéma de l’effet THz Stark. Le champ THz local Elieu dans l’échantillon induit un déplacement d’énergie de l’état fondamental électronique S0 et l’état excité Sex. En conséquence, la fréquence de la transition optique de S0 à Sex (flèches verticales) est modifié. Le signe et l’ampleur du décalage de fréquence dépendent de la projection des moments dipolaires moléculaires µ0 et µex dans les S0 et Sex états dans la direction de Elieu. Le décalage de fréquence est proportionnel au produit de la différence dipolaire projetée Δµ=µex-µ0 et le champ local Elieu. Pour l’échantillon avec des dipôles rétiniens orientés de manière aléatoire dans l’espace, l’expérience fait une moyenne sur toutes les directions dipolaires, ce qui entraîne un élargissement du spectre d’absorption induit par le THz. (b) Changement d’absorption (symboles) induit au maximum du champ électrique THz (temps t = 0) en fonction de la fréquence optique et du spectre d’absorption A0 en l’absence de l’impulsion THz (ligne bleue). L’impulsion THz induit un élargissement spectral transitoire avec une diminution de l’absorption au centre de A0 et une augmentation de l’absorption dans ses ailes. La ligne continue noire est issue d’une analyse numérique des données, donnant un élargissement spectral de ±12 THz et un changement dipolaire Δµ=5 Debye entre S0 et Sex. Crédit : MBI/T. Elsaesser
En appliquant la nouvelle méthode de spectroscopie térahertz (THz) Stark, des chercheurs du Max-Born-Institut et de l’Université Humboldt de Berlin et de l’Université Ludwig Maximilians de Munich ont maintenant déterminé les modifications dipolaires électriques rétiniennes de la bactériorhodopsine (1 THz = 1012 Hz = 1012 oscillations par seconde).
Comme ils le rapportent dans le Actes de l’Académie nationale des sciencesla photoexcitation entraîne une modification modérée du dipôle rétinien d’environ 5 Debye (1,67 × 10-29 CoulombMeter), beaucoup plus petit que prévu pour un S soigné1 caractère de l’état excité.
En revanche, leurs données et analyses théoriques montrent que le mélange du S2 la moyenne d’état et temporelle sur les 120 premières images de la dynamique de l’état excité ultrarapide explique le changement dipolaire mesuré. De tels résultats confortent l’image d’un mélange prononcé d’états quantiques dans la dynamique électronique et nucléaire précoce de la bactériorhodopsine.
La spectroscopie THz Stark utilise une approche pompe-sonde, dans laquelle une impulsion de pompe THz d’une durée de 1 ps (1 ps = 10-12 s) fournit un fort champ électrique externe, qui induit un décalage spectral (Stark) des transitions optiques du fond rétinien vers l’état excité.
Ce décalage est proportionnel à la différence dipolaire ∆µ entre l’état fondamental et l’état excité. Le changement d’absorption résultant de l’échantillon est mesuré par une impulsion de sonde femtoseconde, qui est courte par rapport à l’impulsion THz et sonde ainsi l’impact momentané du champ THz. Pour un échantillon avec une orientation spatiale aléatoire des chromophores rétiniens, on observe un élargissement spectral de la bande d’absorption électronique, à partir de laquelle est dérivé le changement dipolaire ∆µ.
Dans le temps, l’élargissement suit l’intensité de l’impulsion THz ultracourte. Sur cette échelle de temps ultracourte, l’environnement protéique du chromophore est pratiquement gelé, avec un impact négligeable de la dynamique des protéines sur les observables expérimentaux.
De cette manière, la spectroscopie THz Stark permet de mesurer avec précision les moments dipolaires dans les systèmes moléculaires pertinents pour la chimie et la biologie.
Plus d’information:
Jia Zhang et al, La spectroscopie térahertz ultrarapide Stark révèle les moments dipolaires à l’état excité de la rétine dans la bactériorhodopsine, Actes de l’Académie nationale des sciences (2024). DOI : 10.1073/pnas.2319676121
Fourni par le Max Born Institute pour l’optique non linéaire et la spectroscopie à impulsions courtes (MBI)
Citation: Mélange d’états quantiques en photobiologie : nouvel aperçu de la spectroscopie ultrarapide térahertz Stark (25 juin 2024) récupéré le 25 juin 2024 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
