Un nouveau squelette d’ARNsi améliore la stabilité et la durabilité de la plateforme thérapeutique oligonucléotidique
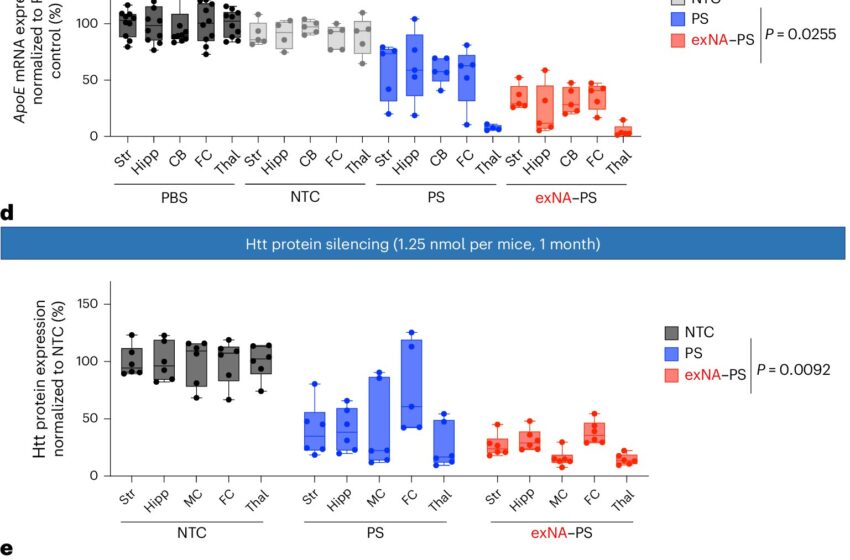
Impact de la modification 3′-exNA sur l’efficacité de l’ARNsi dans le SNC. Crédit : Biotechnologie de la nature (2024). DOI : 10.1038/s41587-024-02336-7
Une percée biochimique utilisant de simples atomes de carbone, par Ken Yamada, Ph.D., et Anastasia Khvorova, Ph.D., a considérablement amélioré la stabilité et l’efficacité d’une plateforme thérapeutique potentielle à base d’oligonucléotides chez la souris. Cette découverte, publiée dans Biotechnologie de la naturea le potentiel d’améliorer la durabilité des médicaments oligonucléotidiques, y compris les petits ARN interférents, et d’apporter ces thérapies à des types de cellules en dehors du foie pour la première fois.
« L’innovation de notre étude est une modification de la composition chimique derrière l’architecture de la plateforme d’oligonucléotides », a déclaré le Dr Khvorova, titulaire de la chaire de recherche biomédicale de la famille Remondi et professeur de thérapie par l’ARN.
« En utilisant un changement relativement simple – l’extension de la chaîne principale de l’ARN avec des atomes de carbone simples – nous avons pu améliorer considérablement la durée de persistance des oligonucléotides dans les cellules en les cachant efficacement aux nucléases qui les décomposent normalement. Ce type de modification est essentiel au succès des médicaments oligonucléotidiques en tant que classe. »
Les médicaments oligonucléotidiques, dont les siRNA, constituent une nouvelle classe de médicaments qui permettent de moduler les gènes responsables de maladies pour obtenir un effet thérapeutique.
Six siRNA ont été approuvés par la Food and Drug Administration (FDA) pour une utilisation clinique, tous dans le foie, et d’autres sont en phase avancée d’essais cliniques. Le premier d’entre eux, le patisiran, désormais vendu sous le nom de marque Onpattro, a été approuvé en 2018 pour les personnes atteintes d’amylose héréditaire à transthyrétine, une maladie hépatique rare et mortelle.
Les oligonucléotides sont cependant très instables à l’état naturel. Les enzymes responsables de la dégradation des molécules d’oligonucléotides, appelées nucléases, agissent très rapidement à l’intérieur des cellules vivantes, ce qui laisse aux médicaments un temps limité pour obtenir un effet thérapeutique.
En conséquence, les scientifiques ont été mis au défi de concevoir des échafaudages chimiques capables de stabiliser, de maintenir et de prolonger la longévité des médicaments oligonucléotidiques nécessaires pour obtenir un succès thérapeutique dans les tissus vivants, en particulier les cellules autres que les cellules hépatiques.
La plupart des modifications des oligonucléotides se concentrent sur la modification des phosphorothioates ou des molécules de sucre présentes dans la structure chimique. Les Dr Yamada et Khvorova ont cependant adopté une approche différente, en se concentrant sur les molécules de carbone présentes dans la structure chimique de la chaîne principale.
« Dans la nature, il a été démontré qu’une ou quelques méthylations des nucléobases et des acides aminés modifient légèrement la structure de l’ADN, de l’ARN et des protéines, ce qui a un impact profond sur l’expression des gènes dans la cellule, un petit changement structurel ayant un impact important dans la cellule », a déclaré Yamada, professeur adjoint de thérapie par l’ARN.
« Ce processus nous a incités à appliquer une approche analogue à la structure de la plateforme oligonucléotidique : un petit changement structurel ayant un impact important sur la durabilité de l’ARNsi grâce à une stabilité accrue et une efficacité améliorée. »
En testant plusieurs permutations, Yamada et Khvorova ont découvert qu’un atome de carbone supplémentaire inséré au bon endroit le long du nucléoside cachait efficacement les molécules d’oligonucléotides de la dégradation par l’enzyme nucléase. Cela a donné lieu à un oligonucléotide plus stable et plus efficace, appelé acide nucléique étendu ou exNA, qui persistait 32 fois plus longtemps que ses homologues modifiés par phosphorothioate.
« Tout dépend de l’endroit et de la manière dont on ajoute le carbone », explique Yamada. « Même une légère modulation structurelle peut avoir un impact considérable sur l’efficacité si elle est effectuée au bon endroit et de la bonne manière. »
Yamada a ajouté : « Si nous pouvions obtenir une augmentation de la persistance ne serait-ce que de 10 fois, nous pourrions réduire la posologie ou la durée du traitement clinique d’une fois toutes les deux semaines à une fois tous les cinq mois. Avoir une augmentation de 32 fois dans les modèles de souris est extrêmement encourageant. »
Khvorova a déclaré : « Les muscles, les reins, le système nerveux central, le pancréas, les yeux – une multitude de tissus et de maladies qui dépassaient nos capacités sont désormais des cibles médicamenteuses potentiellement envisageables pour les thérapies à base d’oligonucléotides. »
La prochaine étape pour les chercheurs consiste à commencer à tester la sécurité et la longévité de leur squelette oligonucléotidique dans le cadre d’essais cliniques.
Plus d’information:
Ken Yamada et al., Améliorer l’efficacité de l’ARNsi in vivo avec des chaînes d’acides nucléiques étendues, Biotechnologie de la nature (2024). DOI : 10.1038/s41587-024-02336-7
Fourni par la faculté de médecine de l’Université du Massachusetts
Citation: Un nouveau squelette d’ARNsi améliore la stabilité et la durabilité de la plateforme thérapeutique oligonucléotidique (2024, 5 août) récupéré le 5 août 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
