Démystifier un récepteur clé dans la consommation de substances et les troubles neuropsychiatriques
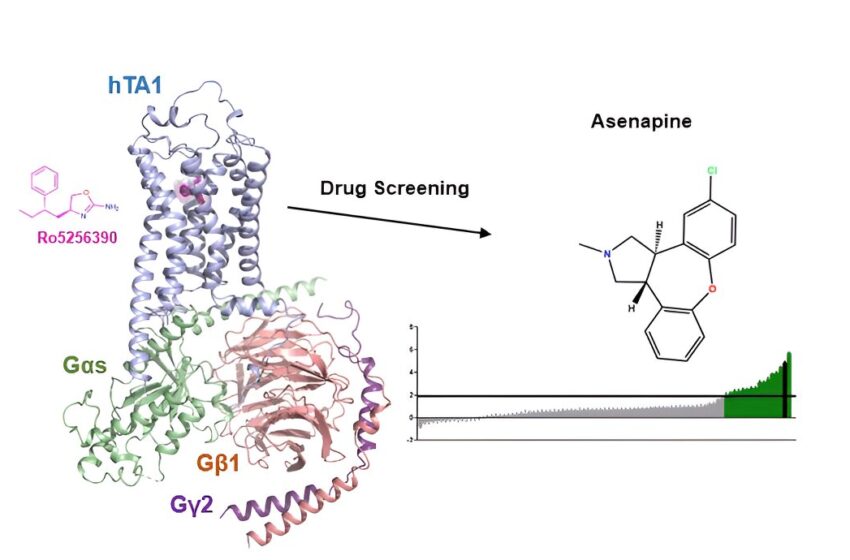
Les scientifiques du mont Sinaï Icahn ont pris des photos détaillées de la façon dont les médicaments peuvent se lier au récepteur TAAR1 à l’aide de CryoEM. Ils ont également découvert qu'un médicament antipsychotique, l'asénapine, active de manière inattendue TAAR1, ce qui pourrait potentiellement contribuer aux effets thérapeutiques de l'asénapine. Crédit : Wacker et coll., Communications naturelles
Des chercheurs de l'École de médecine Icahn du Mont Sinaï ont découvert des informations sur le mécanisme d'action potentiel de l'asénapine, un médicament antipsychotique, une cible thérapeutique possible pour la consommation de substances et les troubles neuropsychiatriques. Cette découverte pourrait ouvrir la voie au développement de médicaments améliorés ciblant la même voie.
Leurs conclusions, publiées dans Communications naturellesmontrent qu'une protéine cérébrale connue sous le nom de récepteur TAAR1, une cible médicamenteuse connue pour réguler la signalisation de la dopamine dans les principales voies de récompense du cerveau, diffère considérablement chez l'homme par rapport aux modèles précliniques de rongeurs sur lesquels les médicaments sont généralement testés.
L'étude suggère de considérer les différences spécifiques aux espèces dans les interactions médicament-récepteur et d'approfondir les recherches sur la manière dont l'asénapine affecte le corps, comme étapes vers des améliorations thérapeutiques potentielles.
“En étudiant les propriétés fonctionnelles et structurelles de TAAR1, notre étude visait à faire la lumière sur ses mécanismes et sa pharmacologie”, explique le premier auteur de l'étude, Gregory Zilberg, titulaire d'un doctorat. candidat à Icahn Mont Sinaï. “Nos résultats pourraient guider le développement de nouveaux médicaments TAAR1 et inciter à davantage d'exploration de médicaments similaires à l'asénapine.”
En utilisant des techniques avancées pour étudier la structure et la fonction de TAAR1, les chercheurs ont identifié trois éléments importants. Premièrement, il existe des différences entre les TAAR1 des rongeurs et des humains qui affectent probablement la manière dont les études sur modèles précliniques peuvent être transposées aux humains. Deuxièmement, TAAR1 est beaucoup plus étroitement lié aux récepteurs de la sérotonine et de la dopamine qu’on ne le pensait auparavant. Cela suggère que plusieurs médicaments ciblant la sérotonine pourraient avoir une efficacité thérapeutique inconnue ou des effets secondaires qui sont en fait dus à leurs actions sur TAAR1.
Enfin, les enquêteurs soulignent que l'asénapine, un antipsychotique utilisé en clinique, montre de manière inattendue une forte activation de TAAR1, ce qui suggère, en fait, que cet antipsychotique ciblant la sérotonine et la dopamine pourrait tirer certains de ses effets thérapeutiques de l'activation de TAAR1.
Si cela est prouvé dans d'autres études, cela pourrait ouvrir de nouvelles possibilités pour son potentiel dans d'autres applications thérapeutiques liées à TAAR1, telles que son utilisation dans les troubles liés à l'usage de substances, ainsi que le développement de nouveaux médicaments à base d'asénapine.
Les chercheurs ont noté l'absence d'informations sur les différences dans le fonctionnement de TAAR1 chez les rongeurs et les humains et ont souligné que certaines de ces différences pourraient expliquer pourquoi les données précliniques sur TAAR1 n'ont pas encore été traduites avec succès en thérapies efficaces chez l'homme. Ensuite, les chercheurs prévoient d’étudier où se trouve TAAR1 dans les cellules et quel est son rôle précis dans l’influence de la signalisation de la sérotonine et de la dopamine.
“Cette étude constitue une avancée significative dans la compréhension de TAAR1, offrant des pistes potentielles pour le développement de médicaments et encourageant la poursuite des recherches sur ses applications thérapeutiques”, déclare l'auteur principal Daniel Wacker, Ph.D., professeur adjoint de sciences pharmacologiques et de neurosciences à Icahn Mount. Sinaï.
« À mesure que nos travaux avancent, nous prévoyons qu'ils pourraient jouer un rôle crucial dans le développement de nouveaux médicaments ciblant TAAR1 et offrir des informations précieuses sur la façon dont des médicaments similaires à l'asénapine pourraient agir.
Plus d'information:
Gregory Zilberg et al, Bases moléculaires de l'activation du récepteur 1 associé aux traces humaines associées aux amines, Communications naturelles (2024). DOI : 10.1038/s41467-023-44601-4
Fourni par l'Hôpital Mont Sinaï
Citation: Démystifier un récepteur clé dans la consommation de substances et les troubles neuropsychiatriques (2 janvier 2024) récupéré le 2 janvier 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
