De nouvelles informations sur les mutations protéiques à l’origine du syndrome de Rett
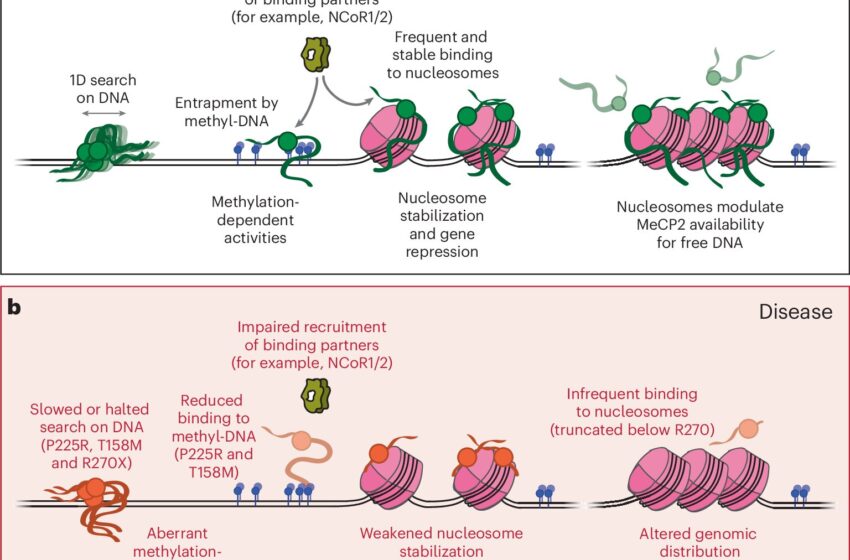
Modèle de travail pour la fonction normale de MeCP2 sur la chromatine et sa dysrégulation dans la maladie. Crédit : Nature Biologie structurale et moléculaire (2024). DOI : 10.1038/s41594-024-01373-9
Une protéine particulière est au cœur du développement du cerveau. Régulatrice majeure de l’expression des gènes, elle est abondamment présente dans les neurones et son dysfonctionnement est à l’origine du syndrome de Rett, un trouble neurologique qui peut entraîner de graves troubles cognitifs, moteurs et de communication chez les jeunes filles.
Pourtant, les scientifiques ne savent pas grand-chose sur la manière dont cette protéine essentielle accomplit son travail crucial au niveau moléculaire. « Les gens étudient cette protéine depuis des décennies sans parvenir à un consensus clair sur ce qu’elle fait, où elle se lie au génome et quelles sont ses fonctions », explique Shixin Liu, de Rockefeller. Aujourd’hui, une nouvelle étude du laboratoire de Liu met en lumière la manière dont la protéine, MeCP2, interagit avec l’ADN et la chromatine.
Les résultats, publiés dans Nature Biologie structurale et moléculaireoffrent un aperçu de ce régulateur principal et pourraient ouvrir de nouvelles voies pour les thérapies du syndrome de Rett.
Une approche à molécule unique
La protéine MeCP2 est une protéine déroutante. Bien qu’elle soit impliquée dans la régulation de milliers de gènes et qu’on pense qu’elle joue un rôle central dans le développement neurologique, ses effets sur le génome sont difficiles à cerner. Des quantités insuffisantes de MeCP2 sauvage provoquent le syndrome de Rett, mais une quantité excessive de cette protéine provoque un trouble neurologique tout aussi invalidant connu sous le nom de syndrome de duplication MeCP2.
Liu et ses collègues ont exploité le domaine d’expertise du laboratoire (observation et manipulation de molécules uniques) pour mieux comprendre comment la protéine MeCP2 interagit avec l’ADN. L’équipe a attaché un seul fragment d’ADN entre des billes de plastique de la taille d’un micron, chacune maintenue par un laser, puis a incubé l’ADN avec des protéines MeCP2 marquées par fluorescence. Cette configuration leur a permis de surveiller de près le comportement dynamique de la mystérieuse protéine.
On pense généralement que MeCP2 exerce ses fonctions exclusivement sur l’ADN modifié par des cytosines méthylées, mais il manquait une explication satisfaisante pour une telle spécificité, puisque la protéine se lie facilement à l’ADN méthylé et non méthylé.
L’équipe a découvert que MeCP2 se déplace de manière dynamique sur l’ADN, mais de manière beaucoup plus lente en ce qui concerne la forme méthylée par rapport à la forme non méthylée. Ils ont également montré que ces différentes dynamiques permettent à MeCP2 de recruter plus efficacement une autre protéine régulatrice sur les sites méthylés de l’ADN, ce qui peut aider à diriger les fonctions de régulation des gènes de MeCP2 vers des emplacements spécifiques au sein du génome.
« Nous avons découvert que MeCP2 glisse plus rapidement le long de l’ADN non méthylé, et cette différence de mouvement peut expliquer comment la protéine fait la différence entre les deux », explique Gabriella Chua, chercheuse diplômée dans le laboratoire de Liu et première auteure de l’article.
« C’est quelque chose que nous n’aurions pu découvrir qu’en utilisant une technique à molécule unique. »
Liu et Chua ont également découvert que la protéine montre une préférence marquée pour la liaison aux nucléosomes, bobines de protéines enroulées avec notre matériel génétique, plutôt qu’à l’ADN nu. Cette interaction stabilise les nucléosomes d’une manière qui peut supprimer la transcription des gènes, ce qui laisse entrevoir la manière dont MeCP2 régule elle-même l’expression des gènes.
Nouvelles réflexions sur les nucléosomes
L’observation selon laquelle un régulateur principal de l’expression des gènes interagit le plus souvent avec cette forme d’ADN étroitement enroulée contribue à renforcer l’idée croissante selon laquelle les nucléosomes sont bien plus que des « bobines de stockage » inertes d’ADN, et que les scientifiques doivent commencer à penser davantage à la fonction de MeCP2 dans le contexte des nucléosomes.
« Nos données constituent l’un des exemples les plus concluants de ce phénomène à ce jour », explique Liu. « Il est clair que MeCP2 préfère se lier aux nucléosomes. »
Ainsi, MeCP2 fonctionne comme une protéine de liaison à la chromatine, contrairement à l’idée reçue selon laquelle elle serait principalement une protéine de liaison au méthyl-ADN. Dans cette étude, l’équipe a également réussi à identifier la partie de la protéine responsable de son activité de liaison au nucléosome.
« L’ADN nu est minoritaire : les nucléosomes sont omniprésents dans nos génomes », explique Chua. « Plusieurs études récentes ont démontré que les nucléosomes ne sont pas seulement des barrières passives à la transcription, mais des points chauds actifs pour la régulation des gènes. »
Un exemple particulièrement frappant de cette fonctionnalité du nucléosome est la façon dont MeCP2 interagit avec lui.
Dans le cadre de ses travaux futurs, l’équipe prévoit d’aller au-delà de l’étude in vitro actuelle pour examiner MeCP2 in vivo, où les interactions entre la protéine et le nucléosome devraient être plus complexes. Ils ont également l’intention d’utiliser les techniques décrites dans cet article pour mieux étudier les nombreuses mutations de MeCP2 qui causent des maladies telles que le syndrome de Rett.
L’espoir est qu’une compréhension plus complète de la protéine centrale de cette maladie dévastatrice puisse un jour conduire à des thérapies.
« Il n’existe pas de traitement curatif contre la maladie de Rett, mais la communauté des chercheurs qui étudient cette maladie est déterminée et motivée. Beaucoup d’entre eux ont trouvé nos données intéressantes lorsque nous les avons partagées avec eux », explique Chua. « Nos résultats montrent comment la recherche fondamentale peut aider la communauté clinique à mieux comprendre une maladie. »
Plus d’informations :
Gabriella NL Chua et al, La dynamique différentielle spécifie la fonction MeCP2 au niveau des nucléosomes et de l’ADN méthylé, Nature Biologie structurale et moléculaire (2024). DOI : 10.1038/s41594-024-01373-9
Fourni par l’Université Rockefeller
Citation:Nouvelles informations sur les mutations protéiques responsables du syndrome de Rett (2024, 26 août) récupéré le 26 août 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
