Les chercheurs découvrent de nouvelles cibles moléculaires de médicaments pour les troubles neurologiques progressifs
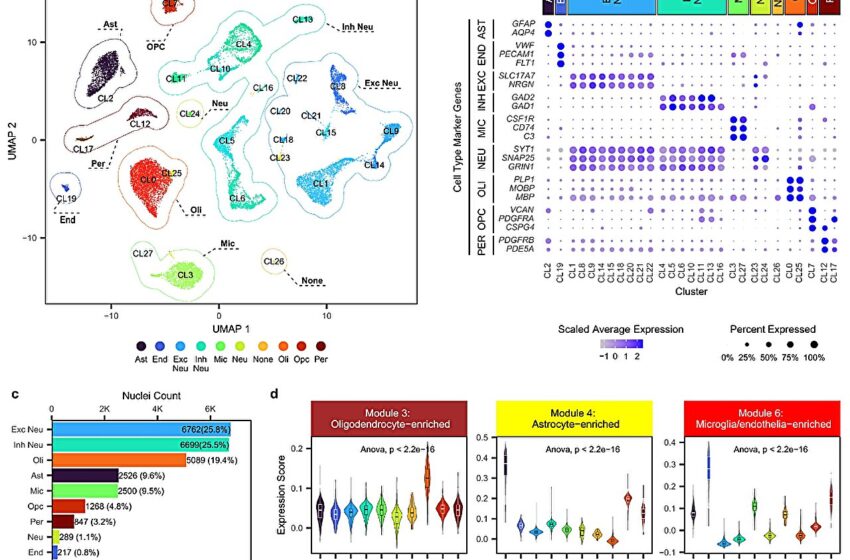
RNAseq à noyau unique capture les changements d’expression gliale dans les cerveaux PSP. un noyau dans l’espace UMAP coloré par numéro de cluster et regroupé par son type de cellule. b Expression moyenne et pourcentage de noyaux exprimés des gènes marqueurs de type cellulaire utilisés pour l’attribution du type de cluster dans chaque cluster snRNAseq. c Nombre et proportions de chaque type de noyaux. d Niveaux d’expression des gènes de module des trois modules d’expression associés à la PSP (M3, M4, M6) enrichis en types cellulaires dans les clusters snRNAseq pour chaque type de cellule. Boxplots indiquant la distribution des scores d’expression et le premier quartile, la médiane et le troisième quartile. La moustache supérieure indique la valeur maximale ne dépassant pas 1,5 fois l’intervalle inter-quartile à partir du troisième quartile. La moustache inférieure indique la valeur minimale ne dépassant pas 1,5 fois l’intervalle interquartile à partir du premier quartile. L’expression a été dérivée en utilisant 26 241 noyaux provenant de 34 PSP et échantillons témoins. Crédit: Communications naturelles (2023). DOI : 10.1038/s41467-023-42626-3
Il n’existe aucun remède contre la paralysie supranucléaire progressive (PSP), un trouble cérébral marqué par des difficultés de marche et d’équilibre. Ses symptômes imitent également la maladie de Parkinson et la démence. Cette maladie entraîne un déclin rapide et progressif, voire la mort.
Dans un nouvel article publié dans Communications naturellesles chercheurs et collaborateurs de Mayo décrivent de nouvelles cibles thérapeutiques qui pourraient conduire à de futurs traitements potentiels pour la PSP, ainsi que pour la maladie d’Alzheimer et les troubles associés.
Les personnes atteintes de PSP sont généralement diagnostiquées entre 60 et 70 ans. Bien que la cause ne soit pas connue, les chercheurs ont découvert que les cellules cérébrales en détérioration des personnes atteintes de PSP contiennent des quantités excessives d’une protéine appelée tau. Des amas de tau sont également retrouvés chez les personnes atteintes d’autres troubles neurodégénératifs, comme la maladie d’Alzheimer.
Dans cette étude, les chercheurs se sont concentrés sur l’ARN, porteur de l’information génétique dans toutes les cellules vivantes. Ils ont intégré les données sur l’ARN cérébral de deux grands groupes d’étude humains indépendants, y compris des échantillons de donneurs provenant de patients atteints de PSP de la Mayo Clinic Brain Bank. Ils ont effectué un séquençage de l’ARN, ce qui leur a permis de découvrir quels gènes de certaines cellules cérébrales étaient anormalement élevés ou faibles chez les patients atteints de PSP.
Chaque groupe d’étude contenait des échantillons de cerveau provenant de personnes décédées des suites d’une PSP, ainsi qu’un groupe témoin d’échantillons de cerveau provenant de personnes non décédées d’une maladie neurodégénérative. Les chercheurs ont utilisé des échantillons provenant de plus de 400 personnes au total.
Après avoir effectué le séquençage de l’ARN, les chercheurs ont utilisé un modèle informatique pour identifier systématiquement près de 5 000 gènes impliqués dans la PSP dans les cellules cérébrales concernées. Ils ont ensuite comparé leurs résultats à une analyse réalisée dans un modèle préclinique qui imite la pathologie cérébrale observée dans la PSP. En fin de compte, les chercheurs ont « classé » ou hiérarchisé 11 gènes de confiance élevée qui sont inhabituellement élevés dans les cerveaux PSP humains et dans ce modèle.
Enfin, les enquêteurs ont manipulé ces gènes cibles dans un modèle expérimental de mouche des fruits. Ils voulaient déterminer si la réduction des niveaux de ces gènes anormalement élevés pouvait corriger la dégénérescence du modèle. Parmi les 11 gènes de confiance élevée, les chercheurs ont découvert que la réduction des niveaux de DDR2, KANK2 et STOM était la plus prometteuse pour inverser la maladie et constituer des cibles majeures pour le développement thérapeutique.
“Cette recherche améliore notre compréhension de la paralysie supranucléaire progressive et d’autres troubles neurologiques incurables associés”, déclare l’auteur principal de l’étude, Nilüfer Ertekin-Taner, MD, Ph.D., neurologue à la Mayo Clinic, neuroscientifique et président du département de neurosciences. “À l’avenir, nous pouvons cibler ces gènes spécifiques ou d’autres qui leur sont biologiquement liés afin de développer un traitement potentiel pour cette maladie incurable.”
L’équipe a également créé une application Web pour permettre le partage de données au sein de la communauté de recherche au sens large.
“Ce projet met en évidence la puissance des données multiomiques”, déclare Yuhao (Harry) Min, étudiant prédoctoral à la Mayo Clinic Graduate School of Biomedical Sciences dans la filière Sciences cliniques et translationnelles et premier auteur de l’article. “Grâce à ces ensembles de données, nous avons pu distinguer les changements moléculaires complexes survenus chez les patients atteints de PSP, qu’il est important de comprendre pour trouver un remède à ce trouble.
« Nous avons également partagé nos ensembles de données avec la communauté scientifique pour permettre des efforts de collaboration, dans le but de trouver un traitement pour les patients. Étant donné que la PSP partage une biologie similaire à celle d’autres troubles neurologiques tels que la maladie d’Alzheimer, nous espérons que nos résultats pourraient également bénéficier aux efforts de découverte de médicaments dans d’autres troubles neurologiques.
Les prochaines étapes de cette recherche consistent à travailler sur la synthèse de petites molécules d’acide nucléique capables de réguler les gènes cibles identifiés dans cette étude. Les chercheurs espèrent évaluer l’innocuité et l’efficacité de ces molécules dans des modèles cellulaires et animaux, dans le but à long terme de commencer des essais cliniques chez des patients PSP.
Plus d’information:
Yuhao Min et al, La biologie des systèmes inter-espèces découvre la DDR2 gliale, STOM et KANK2 comme cibles thérapeutiques dans la paralysie supranucléaire progressive, Communications naturelles (2023). DOI : 10.1038/s41467-023-42626-3
Citation: Des chercheurs découvrent de nouvelles cibles moléculaires de médicaments pour les troubles neurologiques progressifs (3 novembre 2023) récupéré le 3 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
