Lien inattendu découvert entre 2 protéines de risque de schizophrénie
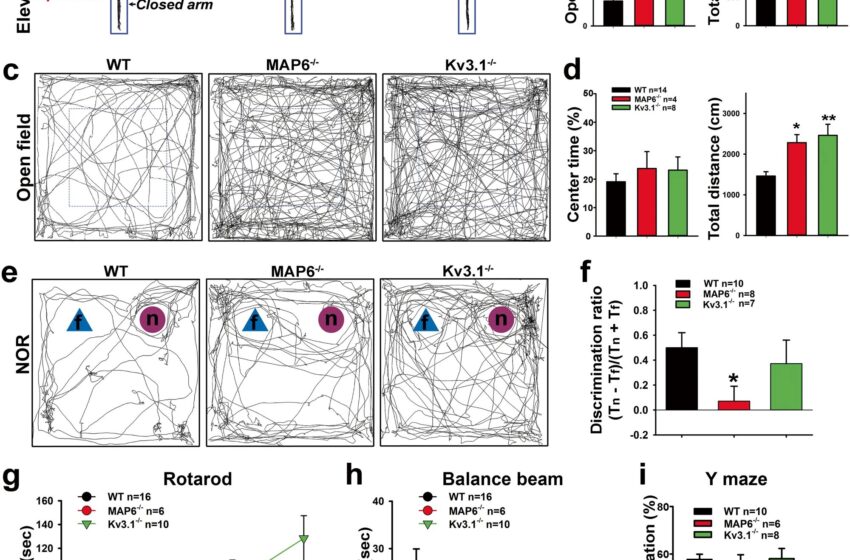
Modifications comportementales dans MAP6−/− et Kv3.1−/− souris. Adulte (3 à 6 mois) WT B6 (barres noires), MAP6−/− (barres rouges) et Kv3.1−/− (barres vertes) des souris ont été utilisées dans une série d’essais comportementaux. Chaque groupe contenait environ une moitié de souris mâles et une moitié de souris femelles. un Exemples de traces dans le labyrinthe surélevé (EPM) avec les bras ouverts indiqués en rouge et les bras fermés en bleu foncé. b Résumés du temps de bras ouvert (100 × TOuvrir/(TOuvrir +TFermé); Contrôle WT, MAP6−/− p = 0,001, Kv3,1−/− p= 0,029) (à gauche) et distance totale parcourue (cm ; contrôle WT, MAP6−/− p = 0,088, Kv3,1−/− p= 0,003)(à droite) en EPM. c Exemples de traces dans le test en champ ouvert avec des lignes pointillées bleues pour indiquer le centre. d Résumés du pourcentage de temps central (100 × TCentre/TTotal; Dans l’ensemble p= 0,595)(à gauche) et la distance totale parcourue (cm ; contrôle WT, MAP6−/− p= 0,045, Kv3,1−/− p= 0,002)(à droite) dans le test en champ ouvert. e Exemples de traces dans le test de reconnaissance d’objets nouveaux (NOR) avec les triangles bleus comme objets familiers (F) et les cercles rouges comme nouveaux objets (n). F Résumé du rapport de sélectivité, (Tn – T.F)/(Tn +TF). Contrôle WT, MAP6−/− p= 0,044, Kv3,1−/− p= 0,096. g Résumé du test de la tige rotative. Dans l’essai n°3, MAP6−/− p= 0,041. Dans l’essai n°4, MAP6−/− p= 0,001. h Résumé du test à la poutre. je Résumé de l’alternance spontanée dans le test du labyrinthe Y (globalement p= 0,801). Chaque résultat est fourni sous forme de moyenne ± SEM. Les numéros de souris sont fournis dans la figure. ANOVA unidirectionnelle suivie du test de Dunnett : *, p< 0,05 ; **, p< 0,01. Crédit: Psychiatrie Moléculaire(2023). DOI : 10.1038/s41380-023-02286-7
La découverte d’une interaction physique entre deux protéines dans les cellules cérébrales, qui peut être attribuée chez la souris au contrôle des mouvements, de l’anxiété et de la mémoire, pourrait un jour ouvrir la porte au développement de nouvelles stratégies de traitement de la schizophrénie, affirment les chercheurs.
Le groupe de recherche est le premier à déterminer que les deux protéines, toutes deux parmi les dizaines de protéines liées au risque de développement de la schizophrénie, se lient l’une à l’autre dans des conditions normales dans plusieurs régions du cerveau, et que leur connexion a été trouvée chez la souris. être la clé du maintien de mouvements normaux, de la fonction de mémoire et de la régulation de l’anxiété.
Lorsque cette connexion ne se produit pas comme elle le devrait, ont-ils découvert, le comportement peut être affecté négativement : chez la souris, la perturbation de la capacité des protéines à interagir augmente l’hyperactivité, réduit l’évitement des risques et la mémoire est altérée. Bien que les délires et les hallucinations soient des symptômes caractéristiques de la schizophrénie, la maladie englobe également d’autres symptômes, notamment des problèmes de mouvement et de mémoire.
“Ces deux protéines ne semblent apparemment pas liées, et notre étude a établi un lien entre elles qui n’avait pas été reconnu auparavant”, a déclaré l’auteur principal Chen Gu, professeur agrégé de chimie biologique et de pharmacologie à l’Ohio State University College of Medicine.
“Il existe plus de 100 gènes qui ont été identifiés comme des gènes à risque pour la schizophrénie, mais nous ne connaissons toujours pas les véritables mécanismes à l’origine de ces risques”, a déclaré Gu. “Nous espérons qu’une meilleure compréhension de ce mécanisme pourrait aider à long terme à trouver un nouveau traitement qui pourrait bénéficier aux patients atteints de schizophrénie.”
L’étude a été publiée récemment dans la revue Psychiatrie Moléculaire.
Des études post-mortem antérieures ont identifié des gènes de risque de schizophrénie sur la base de signes de dysfonctionnement protéique détectés dans le tissu cérébral. Parmi elles se trouvent les protéines étudiées : MAP6, qui joue un rôle dans le soutien du cytosquelette d’un neurone ou, plus précisément, des microtubules, et Kv3.1, qui aide à contrôler la fréquence maximale de signalisation électrique par les neurones.
Le laboratoire de Gu étudie le Kv3.1 depuis de nombreuses années, travaillant souvent avec des souris génétiquement modifiées dépourvues de son gène. Alors que l’équipe commençait à explorer un lien entre Kv3.1 et MAP6, l’auteur de la première étude, Di Ma, étudiant diplômé du laboratoire, a découvert que les souris dépourvues des gènes des deux protéines présentaient des changements de comportement similaires.
“C’est ainsi que nous avons commencé à examiner leur relation plus en détail”, a déclaré Gu.
Dans cette étude, Ma et ses collègues de laboratoire ont examiné de manière plus nuancée la manière dont la connexion des protéines est liée au comportement en perturbant leur capacité à se lier les unes aux autres dans des régions spécifiques du cerveau chez la souris : l’hippocampe, qui régit l’apprentissage et la mémoire, et le l’amygdale voisine, où les émotions sont traitées.
Les chercheurs ont découvert que la perturbation de la connexion des protéines dans l’amygdale entraînait une réduction de l’évitement du risque, ce qui se traduisait chez la souris par un manque de peur de la hauteur. Le blocage de l’attachement des protéines dans l’hippocampe a entraîné une hyperactivité et une moindre reconnaissance d’un objet familier. Bien que certains changements de comportement dans ces expériences diffèrent de la liste plus longue de changements observés chez des souris complètement dépourvues d’un ou des deux gènes, les résultats ont fourni des informations importantes sur les domaines dans lesquels les interactions des protéines, ou leur absence, ont le plus fort effet sur le comportement.
“Différentes fonctions physiologiques dans lesquelles nous sommes engagés quotidiennement sont régies par différentes régions du cerveau”, a déclaré Gu. “C’est une avancée apportée par notre étude. Parce qu’auparavant, nous savions que les souris knock-out globales présentaient ces altérations comportementales, nous ne savions pas vraiment quelle région du cerveau en était responsable.”
La prochaine étape du laboratoire de Gu consistera à explorer les liens entre le comportement social des souris et les fonctions de ces protéines dans le cortex préfrontal, une région cérébrale importante pour la prise de décision et la planification.
Dans une série d’expériences de biochimie et de biologie cellulaire, les chercheurs ont également déterminé comment les protéines se lient et comment cette connexion affecte leur positionnement à l’intérieur des neurones. Les résultats ont montré que MAP6 stabilise le canal Kv3.1 dans un type spécifique d’interneurones, où il aide ces cellules à maintenir les signaux cérébraux à un niveau égal. En revanche, une baisse de l’expression de MAP6 a considérablement diminué le niveau de Kv3.1 dans ces interneurones.
Les résultats combinés suggèrent que lorsque les protéines ne se lient pas correctement, il n’y a pas suffisamment de Kv3.1 disponible pour maintenir la fonction de contrôle du signal des interneurones, ce qui entraîne un déséquilibre de l’inhibition et de l’excitation neuronales dans les régions cérébrales affectées, ainsi qu’un comportement négatif associé. symptômes. Ce type d’interneurones, capables de générer des influx nerveux à hautes fréquences, représente une cible thérapeutique clé pour la schizophrénie.
“Notre étude fournit en outre un lien entre le dysfonctionnement de MAP6 et le dysfonctionnement du signal interneurone, et nous savons maintenant qu’il existe deux protéines qui interagissent et que l’une pourrait modifier l’autre”, a déclaré Gu. “Cela ouvre de nouvelles directions potentielles pour les stratégies de traitement.”
Plus d’information:
Di Ma et al, Une interaction cytosquelette-membrane conservée dans les neurones à pointe rapide contrôle le mouvement, l’émotion et la mémoire, Psychiatrie Moléculaire(2023). DOI : 10.1038/s41380-023-02286-7
Fourni par l’Université d’État de l’Ohio
Citation: Lien inattendu trouvé entre 2 protéines de risque de schizophrénie (26 octobre 2023) récupéré le 26 octobre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
