Une nouvelle stratégie de synthèse de la (–)-gukulénine A révèle la chimie derrière ses effets anticancéreux
Les scientifiques ont réalisé la première synthèse totale énantiosélective de (–)-gukulénine A. Crédit : Science (2025). DOI:10.1126/science.aea9310
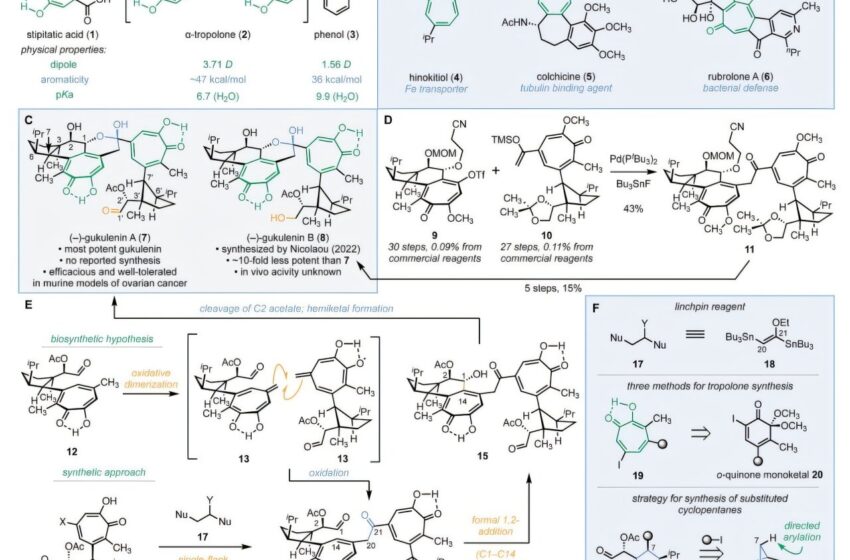
Une équipe de chercheurs de l’Université de Yale, aux États-Unis, a réalisé avec succès la première synthèse stéréosélective du produit naturel complexe (-)-gukulénine A (7), qui présente une cytotoxicité notable contre le cancer de l’ovaire.
La (–)-gukulénine A est connue pour pousser les chimistes dans leurs retranchements en raison de ses motifs moléculaires difficiles : deux α-tropolones qui sont des anneaux aromatiques à sept chaînons avec de puissants dipôles moléculaires, 10 stéréocentres 3D précis et des groupes chimiques fragiles comme un hémicétal et un aldéhyde.
Le chercheur a surmonté la barrière de la synthèse grâce à une stratégie intelligente d’assemblage à trois composants inspirée des voies biosynthétiques. Après avoir réussi à construire la molécule, ils ont conçu 15 autres dérivés pour identifier les caractéristiques structurelles derrière le pouvoir cytotoxique de la (–)-gukulénine A.
Leurs recherches les ont conduits à des α-tropolones dimères, au moins 10 fois plus puissantes que leurs homologues monomères et, dans certains cas, 200 fois plus puissantes.
Les résultats sont publiés dans Science.
Caché dans l’éponge
Depuis les années 1950, lorsque les structures moléculaires uniques des α-tropolones ont été théorisées, les chimistes synthétiques ont été captivés par ces molécules.
Il s’agissait d’abord de démystifier la structure de la molécule, puis d’étudier ses propriétés chimiques et de trouver ses dérivés dans la nature.
Au fil des années, les chercheurs ont extrait une large gamme d’α-tropolones des écorces d’arbres, des fleurs et des bactéries. La famille de molécules apparentées à la (–)-gukulénine A a été découverte dans l’éponge marine Phorbas gukulensis, collectée près de l’île de Gageodo, en Corée du Sud.
Peu de temps après, les chercheurs ont découvert que les gukulénines possédaient une activité biologique remarquable. La (–)-gukulénine A, en particulier, est apparue comme une cytotoxine puissante, réduisant la taille des tumeurs ovariennes de plus de 92 % dans des études sur des souris. Contrairement à de nombreux produits naturels largement cytotoxiques, il a démontré une sélectivité notable et a été bien toléré dans les modèles animaux.
La capacité de synthétiser cette molécule à grande échelle pourrait ouvrir la porte à de nouvelles options thérapeutiques pour le cancer de l’ovaire, mais le processus de synthèse délicat a longtemps entravé cet objectif.

L’équipe a créé 15 dérivés pour sonder les caractéristiques structurelles à l’origine de la cytotoxicité.Crédit : Science (2025). DOI:10.1126/science.aea9310
L’assemblage à trois composants
Dans cette recherche, l’équipe a adopté une stratégie en trois étapes pour relever le défi de la synthèse : construire les deux moitiés, assembler ces moitiés et fermer les anneaux finaux.
Pour la première partie, ils ont commencé avec l’exo-2-norbornylamine facilement disponible, une molécule bicyclique rigide qui dirigeait naturellement l’arrangement 3D. Ils ont ensuite développé une nouvelle méthode d’expansion de cycle pour transformer un cycle à 6 chaînons en la structure tropolone à 7 chaînons nécessaire aux monomères. Les deux monomères ont finalement été joints à l’aide d’un réactif de liaison à deux carbones nouvellement créé et inconnu jusqu’alors : le (E)-1,2-di(tributylstannyl)-1-éthoxyéthylène.
La dernière étape consistait à fermer le délicat anneau hémicétal. Remarquablement, l’équipe y est parvenue simplement en chauffant l’intermédiaire à 120 °C, déclenchant une réaction précise qui a fermé l’anneau.
Après avoir produit avec succès la (–)-gukulénine A, les chercheurs ont utilisé la même procédure pour concevoir 15 autres dérivés. Ils ont testé et comparé leur cytotoxicité sur quatre lignées de cellules cancéreuses humaines : poumon, côlon, leucémie et ovaire.
Alors que la puissance de la gukulénine A variait selon les types de cancer, la tendance qui restait constante était que les molécules avec des anneaux dimères d’α-tropolone étaient au moins 10 fois plus puissantes que les molécules monomères.
Les chercheurs suggèrent que le pouvoir cytotoxique pourrait provenir de l’affinité de l’α-tropolone pour les métaux divalents, permettant à la (–)-gukulénine A de se fixer simultanément à deux protéines contenant des métaux distinctes.
Ces informations peuvent aider à jeter les bases de la détermination des cibles de la (–)-gukulénine A (7) et à préparer le terrain pour l’évaluation préclinique de ses dérivés synthétiques en tant qu’agents anticancéreux.
Écrit pour vous par notre auteur Sanjukta Mondal, édité par Sadie Harley, et vérifié et révisé par Robert Egan, cet article est le résultat d’un travail humain minutieux. Nous comptons sur des lecteurs comme vous pour maintenir en vie le journalisme scientifique indépendant. Si ce reporting vous intéresse, pensez à faire un don (surtout mensuel). Vous obtiendrez un sans publicité compte en guise de remerciement.
Plus d’informations :
Vaani Gupta et al, Assemblage à trois composants et relations structure-fonction de (–)-gukulenin A, Science (2025). DOI : 10.1126/science.aea9310
© 2025 Réseau Science X
Citation: Une nouvelle stratégie de synthèse de la (–)-gukulénine A révèle la chimie derrière ses effets anticancéreux (18 novembre 2025) récupéré le 18 novembre 2025 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre informatif uniquement.
