Les scientifiques créent des greffes de cellules et de tissus de donneurs « masqués » qui échappent au rejet par le système immunitaire
Dans le cadre d’une percée préclinique qui pourrait transformer les thérapies cellulaires pour les maladies incurables, des chercheurs de Sinai Health et de l’Université de Toronto ont développé une technologie qui pourrait un jour éliminer le besoin de médicaments immunosuppresseurs chez les patients transplantés.
Grâce à la modification génétique des cellules du donneur, les chercheurs ont réussi à créer des greffes qui ont persisté à long terme chez la souris sans nécessiter de suppression immunitaire. Les résultats suscitent l’espoir qu’une stratégie similaire pourrait être utilisée chez les patients humains, rendant potentiellement la transplantation plus sûre et plus largement disponible.
“Notre travail ouvre la voie à un approvisionnement en cellules “prêt à l’emploi” pour des thérapies qui pourraient être administrées en toute sécurité à de nombreux patients”, a déclaré Andras Nagy, chercheur principal à l’Institut de recherche Lunenfeld-Tanenbaum (LTRI) de Sinai Health et professeur. à la faculté de médecine Temerty de l’Université de Toronto, qui a dirigé la recherche.
Le journal Génie biomédical naturel a publié la recherche.
Le rejet immunitaire pose un défi important dans la thérapie cellulaire par donneur, a déclaré Nagy, pionnier des cellules souches et titulaire de la Chaire de recherche du Canada sur les cellules souches et la régénération. Dans de tels cas, le système immunitaire du receveur reconnaît les cellules greffées comme des envahisseurs étrangers et lance une attaque, conduisant au rejet.
“Les patients transplantés et traités par thérapie cellulaire doivent prendre des médicaments immunosuppresseurs, parfois pour le reste de leur vie, pour empêcher leur corps de rejeter la greffe”, a expliqué Nagy. L’utilisation prolongée de ces médicaments peut entraîner de graves problèmes de santé, notamment des infections récurrentes et un risque élevé de cancer.
Les scientifiques du monde entier ont exploré diverses solutions, notamment la création de cellules thérapeutiques à partir des propres cellules du patient ou l’encapsulation des cellules du donneur dans un matériau inorganique pour les protéger.
Ces méthodes sont confrontées à des défis tels que des coûts élevés, des temps de préparation longs et une réponse immunitaire contre les corps étrangers, ce qui complique leurs applications généralisées et rentables.
Les cellules souches ont la capacité unique de se diviser indéfiniment et de donner naissance à des cellules spécialisées qui forment nos organes. Ils constituent une source idéale pour les thérapies cellulaires, car un grand nombre de cellules peuvent être obtenues et converties en types de cellules souhaités pour remplacer celles perdues à cause d’une maladie ou d’une blessure. Mais il existe de gros problèmes de sécurité. En plus de s’intéresser à l’adéquation immunitaire, les scientifiques doivent s’assurer qu’il ne reste dans la greffe aucune cellule en division indésirable susceptible de provoquer un cancer à l’avenir.
Nagy, qui a créé la première lignée de cellules souches embryonnaires humaines au Canada en 2005, a consacré sa vie à concevoir des mesures de protection pour les futures thérapies cellulaires. En 2018, son équipe a publié un article historique dans Nature à propos d’un « kill-switch » induit par un médicament appelé FailSafe qui protège du cancer en éliminant les cellules proliférantes indésirables lors des greffes.
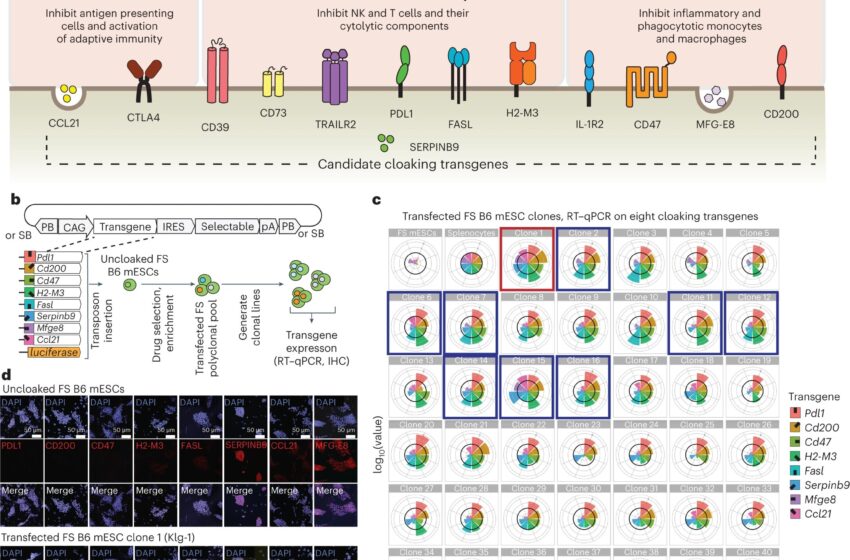
Pour l’étude actuelle, le boursier postdoctoral Jeff Harding et le Ph.D. L’étudiante Kristina Vintersten-Nagy a combiné la technologie kill-switch avec une stratégie qu’elle a appelée « dissimulation immunitaire ».
L’équipe de Nag a sélectionné huit gènes clés liés à la fonction immunitaire (Pdl1, Cd200, Cd47, H2-M3, Fasl, Serpinb9, CCl21 et Mfge8) qui régulent la manière dont le système immunitaire répond aux menaces, notamment aux cellules étrangères. La surexpression forcée de ces gènes dans les cellules souches embryonnaires de souris (MESC) a empêché le système immunitaire de les reconnaître comme étrangers.
La modification a effectivement créé une enveloppe immunitaire autour des cellules après leur injection sous la peau d’hôtes génétiquement inégalés.
« La sécurité des patients est primordiale, et le Dr Andras Nagy est reconnu mondialement pour ses efforts soutenus visant à développer des garanties pour les futures thérapies cellulaires », a déclaré Anne-Claude Gingras, directrice du LTRI et vice-présidente de la recherche à Sinai Health, qui est également professeur de génétique moléculaire à Temerty Medicine.
“Cette étude démontre le potentiel combiné de FailSafe et du masquage immunitaire pour la création d’une source universelle de cellules qui pourrait être appliquée à une multitude de maladies”, a-t-elle déclaré.
Les cellules non masquées sont généralement rejetées dans les dix jours suivant la transplantation. En revanche, les cellules masquées ont persisté pendant plus de neuf mois à la fin de l’expérience, une période longue si l’on considère que les souris vivent environ deux ans. “C’est la première fois que nous parvenons à atteindre une durée aussi longue sans rejet dans un système immunitaire pleinement fonctionnel”, a déclaré Nagy, également professeur à l’Université Monash en Australie.
Dans une autre découverte clé, les chercheurs ont montré que les cellules non modifiées peuvent échapper au rejet lorsqu’elles sont intégrées dans le tissu créé par les cellules masquées du donneur sous la surface de la peau. La protection s’étendait aux cellules d’une autre espèce, comme le montre la capacité des cellules humaines non modifiées à survivre au sein du greffon de souris masqué.
Cela suggère que les cellules modifiées agissent également comme un site d’implantation immunitaire privilégié pour les cellules non modifiées, ce qui a des implications pour les transplantations interspécifiques. Des chercheurs d’autres institutions explorent le potentiel des porcs comme donneurs, car leurs organes sont très similaires en taille et en fonction à ceux des humains.
Fort de ce succès, le doctorat. L’étudiant Huijuan Yang a sélectionné des homologues humains des huit gènes immunomodulateurs et les a utilisés pour créer les premières cellules humaines FailSafe et masquées. La co-culture de ces cellules aux côtés de cellules immunitaires humaines provenant d’un hôte inégalé a révélé leur capacité à échapper à la destruction, contrairement à leurs homologues non modifiés.
Cela montre que le masquage a le potentiel de fonctionner également pour les patients humains, a déclaré Nagy, titulaire d’un poste au département d’obstétrique et de gynécologie de l’Université de Toronto.
Même si la recherche en est encore à ses débuts, elle est très prometteuse pour la médecine régénérative et les thérapies cellulaires. Nagy envisage d’injecter des cellules productrices d’insuline non masquées, ou îlots, dans du tissu sous-cutané masqué pour traiter le diabète. L’administration de cellules sous-cutanées peut être moins risquée pour les patients que l’approche actuelle, dans laquelle des îlots sont délivrés dans le foie et peuvent interférer avec son fonctionnement normal, a déclaré Nagy.
“Cette étude donne des informations inestimables sur des alternatives élégantes aux conséquences toxiques de l’immunosuppression conventionnelle”, a déclaré Michael Sefton, directeur scientifique de Medicine by Design, une initiative de médecine régénérative à l’Université de Toronto, et professeur d’université au département de génie chimique et appliqué. chimie ainsi qu’à l’Institut de génie biomédical de l’Université de Toronto.
“Ces résultats font progresser considérablement les thérapies cellulaires qui peuvent aider les personnes atteintes de maladies chroniques telles que le diabète de type 1 ou l’insuffisance cardiaque”, a déclaré Sefton.
Au-delà du diabète, Nagy développe également des applications pour les patients souffrant de dégénérescence maculaire liée à l’âge, d’arthrite, de douleurs chroniques et de maladies pulmonaires. Pour apporter plus rapidement ces avancées aux patients, il a cofondé une start-up, panCELLa, qui a récemment fusionné avec la société américaine Pluristyx pour continuer à développer des cellules thérapeutiques prêtes à l’emploi, sûres et rentables.
Plus d’information:
Jeffrey Harding et al, Les tissus immunitaires privilégiés formés à partir de cellules souches embryonnaires de souris immunologiquement masquées survivent à long terme chez des hôtes allogéniques, Génie biomédical naturel (2023). DOI : 10.1038/s41551-023-01133-y
Fourni par l’Université de Toronto
Citation: Des scientifiques créent des greffes de cellules et de tissus de donneurs « masqués » qui échappent au rejet par le système immunitaire (29 novembre 2023) récupéré le 29 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.
