Des scientifiques résolvent le mystère de la détection et de la réparation des dommages à l’ADN causés par la lumière du soleil, l’alcool et la pollution
Crédits : Laboratoire des sciences médicales du MRC, Laboratoire de biologie moléculaire du MRC
Une collaboration entre des chercheurs du Laboratoire des sciences médicales (LMS) de Londres et du Laboratoire de biologie moléculaire (LMB) de Cambridge a résolu un mystère vieux de plusieurs décennies qui pourrait ouvrir la voie à de meilleurs traitements contre le cancer à l’avenir.
Ces travaux, qui ont permis de découvrir le mécanisme de base par lequel l’un de nos systèmes de réparation de l’ADN les plus essentiels reconnaît les dommages de l’ADN et initie leur réparation, ont échappé aux chercheurs pendant de nombreuses années. En utilisant des techniques d’imagerie de pointe pour visualiser la façon dont ces protéines de réparation de l’ADN se déplacent sur une seule molécule d’ADN et la microscopie électronique pour capturer la façon dont elles se « fixent » à des structures d’ADN spécifiques, cette recherche ouvre la voie à des traitements plus efficaces contre le cancer.
La collaboration entre les laboratoires du professeur David Rueda (LMS) et du Dr Lori Passmore (LMB) a été un brillant exemple de la manière dont la #scienceenéquipe peut produire des résultats fructueux et souligne l’importance de ces deux instituts pour faire avancer la recherche qui révèle les mécanismes fondamentaux de la biologie qui sous-tendront la traduction future de ce travail en améliorations de la santé humaine.
Les chercheurs travaillaient sur une voie de réparation de l’ADN, connue sous le nom de voie de l’anémie de Fanconi (AF), qui a été identifiée il y a plus de 20 ans.
Tout au long de notre vie, l’ADN est constamment endommagé par des facteurs environnementaux, notamment les rayons UV du soleil, la consommation d’alcool, le tabagisme, la pollution et l’exposition aux produits chimiques. L’ADN est notamment endommagé lorsqu’il est « réticulé », ce qui l’empêche de se répliquer et d’exprimer normalement les gènes.
Pour se répliquer et lire et exprimer les gènes, les deux brins de la double hélice d’ADN doivent d’abord se décomposer en brins simples. Lorsque l’ADN est réticulé, les « nucléotides » (les « marches » de l’échelle de la double hélice de l’ADN) des deux brins se collent ensemble, empêchant cette décompression.
L’accumulation de dommages à l’ADN, notamment les liaisons croisées, peut conduire au cancer. La voie FA est active tout au long de notre vie et identifie ces dommages et les répare en permanence.
Les individus porteurs de mutations qui rendent cette voie moins efficace sont beaucoup plus susceptibles de développer un cancer. Bien que les protéines impliquées dans la voie FA aient été découvertes il y a quelque temps, un mystère demeure quant à la manière dont elles ont identifié l’ADN réticulé et déclenché le processus de réparation de l’ADN.
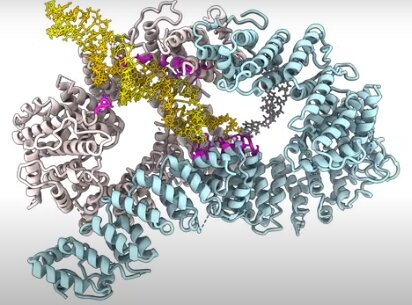
L’équipe de l’institution sœur du MRC LMS, le LMB de Cambridge, dirigée par Lori Passmore, avait précédemment identifié que le complexe protéique FANCD2-FANCI (D2-I), qui agit dans l’une des premières étapes de la voie FA, se fixe sur l’ADN, initiant ainsi la réparation de l’ADN au niveau des liaisons croisées.
Cependant, des questions clés demeurent : comment D2-I reconnaît-il l’ADN réticulé et pourquoi le complexe D2-I est-il également impliqué dans d’autres types de dommages à l’ADN ?
La recherche, publiée dans Naturea utilisé une combinaison de techniques scientifiques de pointe pour montrer que le complexe D2-I glisse le long de l’ADN double brin, surveillant son intégrité, et a également visualisé avec élégance comment il reconnaît où s’arrêter, permettant aux protéines de se déplacer et de se verrouiller ensemble à ce point pour initier la réparation de l’ADN.
Artur Kaczmarczyk et Korak Ray du groupe d’imagerie de molécule unique de David Rueda, en collaboration avec Pablo Alcón du groupe de Lori Passmore, ont utilisé une technique de microscopie de pointe connue sous le nom de « pinces optiques corrélées et imagerie par fluorescence » pour explorer comment le complexe D2-I glisse le long d’une molécule d’ADN double brin.
À l’aide de pinces optiques, ils ont pu attraper une seule molécule d’ADN entre deux billes, ce qui leur a permis de manipuler précisément l’ADN et de l’incuber avec les protéines choisies.
En utilisant du D2-I marqué par fluorescence et l’imagerie de molécules individuelles, ils ont observé comment les complexes D2-I individuels se lient à l’ADN et glissent le long de celui-ci, en balayant la double hélice. Ils ont découvert qu’au lieu de reconnaître directement la liaison croisée entre les deux brins d’ADN, la pince FA cesse de glisser lorsqu’elle atteint un espace d’ADN monocaténaire, une région où l’un des deux brins d’ADN est manquant.
En utilisant la cryomicroscopie électronique, une technique puissante qui permet de visualiser les protéines à l’échelle moléculaire, les chercheurs ont ensuite déterminé les structures du complexe D2-I à la fois dans sa position de glissement et bloquée à la jonction entre l’ADN simple brin et l’ADN double brin.
Cela a révélé que les contacts que D2-I établit avec cette jonction ADN simple brin-double brin sont distincts des contacts qu’il établit avec l’ADN double brin seul.
Cela leur a permis d’identifier une partie spécifique de la protéine FANCD2, appelée « hélice KR », dont ils ont montré, dans leurs expériences d’imagerie de molécule unique, qu’elle est essentielle pour reconnaître et bloquer les lacunes de l’ADN monocaténaire.
En collaboration avec Guillaume Guilbaud et Julian Sale de la division PNAC du LMB, et Themos Liolios et Puck Knipscheer de l’Institut Hubrecht, aux Pays-Bas, ils ont en outre montré que la capacité du complexe D2-I à se bloquer à ces jonctions en utilisant l’hélice KR est essentielle pour la réparation de l’ADN par la voie FA.
Lorsque l’ADN se réplique normalement dans nos cellules, il sépare les deux brins d’ADN et copie chaque brin. Cela crée une « fourche de réplication » où les brins d’ADN d’origine sont déroulés et un nouvel ADN double brin se forme sur chaque brin. Cependant, lorsque cette fourche atteint une liaison croisée de l’ADN, les brins ne peuvent pas être séparés, ce qui bloque le processus habituel de réplication de l’ADN.
Cette fourche de réplication bloquée contient donc des espaces simples exposés où l’ADN a été déroulé mais pas répliqué. Cette recherche a montré que ce sont ces jonctions entre l’ADN simple et double brin au niveau de la fourche de réplication bloquée sur lesquelles le complexe protéique D2-I s’accroche fermement.
Non seulement cela permet au complexe D2-I d’amener d’autres protéines de la voie FA à la liaison croisée de l’ADN pour initier la réparation, mais il ancre également l’ADN double brin restant, protégeant la « fourche de réplication » bloquée des enzymes de la cellule qui pourraient ronger l’extrémité exposée du brin d’ADN et endommager davantage l’ADN.
Ces travaux ont montré que ce sont les structures de l’ADN au sein de la fourche de réplication qui se bloquent en raison de l’ADN réticulé, plutôt que l’ADN réticulé lui-même, qui déclenchent l’arrêt du glissement du complexe D2-I et son adhérence à l’ADN pour initier la réparation. Ces fourches de réplication bloquées apparaissent dans de nombreux types de dommages à l’ADN, ce qui explique le rôle important du complexe D2-I dans d’autres formes de réparation de l’ADN ainsi que via la voie FA.
Il est très important de comprendre le processus de réparation de l’ADN et, surtout, les raisons de son échec, car les dommages à l’ADN sont un facteur clé dans de nombreuses maladies. De nombreux médicaments contre le cancer, comme le cisplatine, agissent en provoquant des dommages cellulaires si graves aux cellules cancéreuses qu’elles cessent de se diviser et meurent.
Dans de tels cas, les voies de réparation de l’ADN, un processus physiologique vital dans la vie normale, peuvent être détournées par les cellules cancéreuses qui les utilisent pour résister aux effets des médicaments de chimiothérapie. La compréhension des mécanismes de base de la première étape de la voie de réparation de l’ADN pourrait permettre de mieux sensibiliser les patients afin que les médicaments contre le cancer soient plus efficaces à l’avenir.
Plus d’information:
Lori Passmore, FANCD2–FANCI étudie l’ADN et reconnaît les jonctions double brin à simple brin, Nature (2024). DOI : 10.1038/s41586-024-07770-w. www.nature.com/articles/s41586-024-07770-w
Fourni par le Laboratoire des sciences médicales du Medical Research Council (MRC)
Citation: Des scientifiques résolvent le mystère de la détection et de la réparation des dommages à l’ADN causés par la lumière du soleil, l’alcool et la pollution (31 juillet 2024) récupéré le 31 juillet 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
