Des chercheurs identifient le régulateur de « contrôle de qualité » du repliement des protéines dans l’organisme, ce qui pourrait conduire à des traitements ciblés
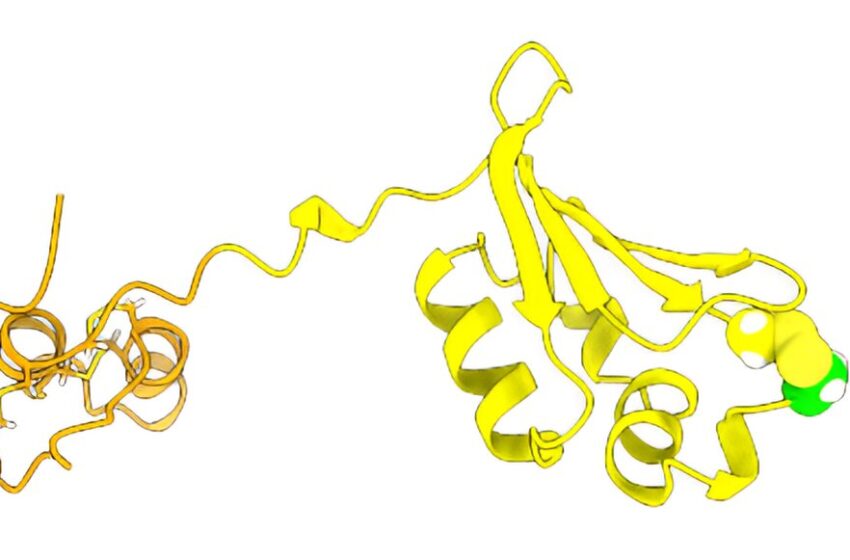
L’équipe a prédit une structure de gant de receveur pour la protéine Sep15. Crédit : Williams et al.
Quiconque a déjà essayé de plier soigneusement un drap-housse vous le dira : plier est une tâche difficile. Si vous vous trompez dans le pliage de votre linge, vous risquez d’obtenir un tissu froissé et froissé, mais si le pliage échoue parmi les quelque 7 000 protéines d’une complexité proche de celle de l’origami qui régulent les fonctions cellulaires essentielles, le résultat peut conduire à l’une des nombreuses maladies graves allant de l’emphysème à la fibrose kystique en passant par la maladie d’Alzheimer.
Heureusement, notre corps dispose d’un système de contrôle qualité qui identifie les protéines mal repliées et les marque soit pour un travail de repliement supplémentaire, soit pour leur destruction, mais on ne sait pas exactement comment fonctionne ce processus de contrôle qualité.
Des chercheurs de l’Université du Massachusetts à Amherst ont fait un grand pas en avant dans notre compréhension du fonctionnement de ce système de contrôle de la qualité en découvrant le « point chaud » où toute l’action se déroule. La recherche a été récemment publiée dans la revue Actes de l’Académie nationale des sciences.
L’ADN est peut-être le schéma directeur de la vie, mais c’est à partir de protéines que nous sommes construits. Si la plupart d’entre elles sont structurellement simples, il existe environ 7 000 protéines qui doivent être fabriquées dans la voie de sécrétion d’une cellule et qui seront soit dispersées dans toute la cellule, soit sécrétées dans l’espace extracellulaire afin de remplir leurs fonctions essentielles.
L’histoire commence dans le réticulum endoplasmique – les usines de protéines cellulaires responsables de la construction correcte de milliers de protéines différentes – et implique deux acteurs principaux : une enzyme connue sous le nom d’UGGT et la protéine partenaire Sep15.
Les auteurs principaux Daniel Hebert, professeur de biochimie et de biologie moléculaire à l’UMass Amherst, et Lila Gierasch, professeure distinguée de biochimie, de biologie moléculaire et de chimie à l’UMass Amherst, ainsi que le co-auteur, Kevin Guay, étudiant diplômé du programme de biologie cellulaire moléculaire de l’UMass Amherst, avaient montré dans des recherches précédentes que l’UGGT agit comme un « gardien » en lisant les étiquettes glucidiques, appelées N-glycanes, intégrées dans la protéine pour déterminer si la protéine est correctement repliée ou non.
« Mais il y a autre chose qui entre en jeu », explique l’auteur principal Rob Williams, chercheur postdoctoral et titulaire d’un poste conjoint dans les laboratoires de Hebert et de Gierasch. « Il existe un club exclusif de protéines appelées « sélénoprotéines », qui contiennent un élément rare, le sélénium.
« Sur les quelque 20 000 protéines différentes présentes dans notre corps, seules 25 sont des sélénoprotéines. La protéine Sep15, qui est associée à l’UGGT, est une sélénoprotéine. Sep15 est toujours associée à l’UGGT. Mais jusqu’à présent, personne ne savait ce qu’elle faisait là. »
En utilisant un modèle d’IA appelé AlphaFold2, Williams et ses co-auteurs ont prédit que la protéine Sep15 forme une forme hélicoïdale complexe qui ressemble à un gant de receveur, et que ce gant correspond parfaitement à un site complémentaire sur l’enzyme UGGT. Le site spécifique où se lient SEP15 et UGGT est également celui où l’UGGT lit le code N-glycane qui lui indique si une protéine est correctement repliée ou non.
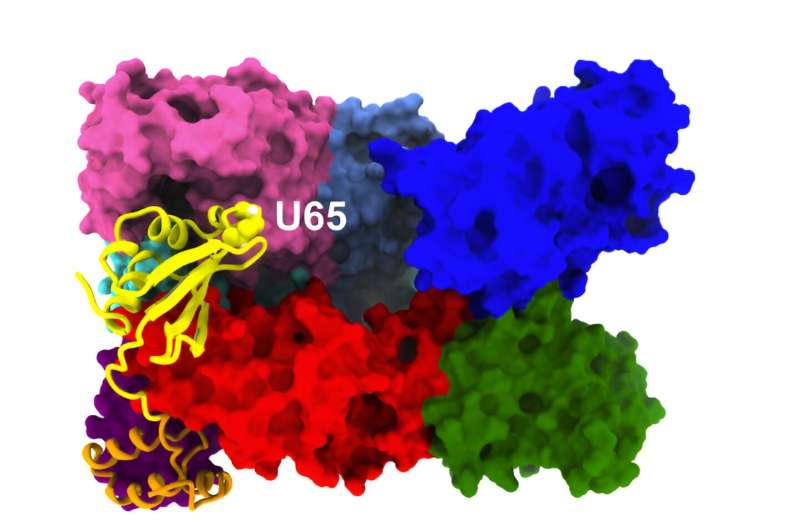
Sep15 « attrape » parfaitement le bon endroit sur l’enzyme UGGT. Crédit : Williams et al.
« En gros », explique Hebert, « nous avons trouvé le point névralgique où toute l’action se déroule – et le 15 septembre en est la clé. »
Pour tester leur prédiction générée par AlphaFold2, l’équipe de recherche a conçu une expérience utilisant la réingénierie de l’ADN recombinant de l’UGGT pour interrompre sa liaison à Sep15 – et, en effet, l’UGGT modifié n’a pas réussi à former un complexe avec Sep15.
Alors, que fait exactement Sep15 ? « Il y a deux possibilités, que nous étudions toutes les deux », explique Hebert. « Soit Sep15 donne à la protéine mal repliée une chance de corriger sa forme, soit il marque cette protéine pour la détruire. »
« La complexité des protéines que nous étudions permet aux formes de vie supérieures de fonctionner », explique Gierasch, « mais la complexité de ces protéines signifie également qu’elles sont plus sujettes aux erreurs de repliement, et les erreurs de repliement peuvent avoir des conséquences catastrophiques si le processus de contrôle qualité échoue. »
Bien qu’il reste encore beaucoup de recherches fondamentales à faire, les travaux de l’équipe ouvrent la voie à de nouvelles thérapies médicamenteuses ciblant l’interface Sep15/UGGT. « Il s’agit d’un domaine pharmaceutique inexploité », déclare Hebert, « et les recherches de Williams nous ont fait avancer dans la bonne direction pour un traitement éventuel. »
Plus d’informations :
Hebert, Daniel N. et al, Aperçu de l’interaction entre l’UGGT, le gardien du repliement dans le RE, et son partenaire, la sélénoprotéine SEP15, Actes de l’Académie nationale des sciences (2024). DOI: 10.1073/pnas.2315009121
Fourni par l’Université du Massachusetts à Amherst
Citation:Les chercheurs identifient le régulateur de « contrôle de la qualité » du corps pour le repliement des protéines, ce qui pourrait conduire à des traitements ciblés (2024, 12 août) récupéré le 12 août 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
