Une étude Cryo-ET élucide les auxiliaires du repliement des protéines dans leur environnement naturel
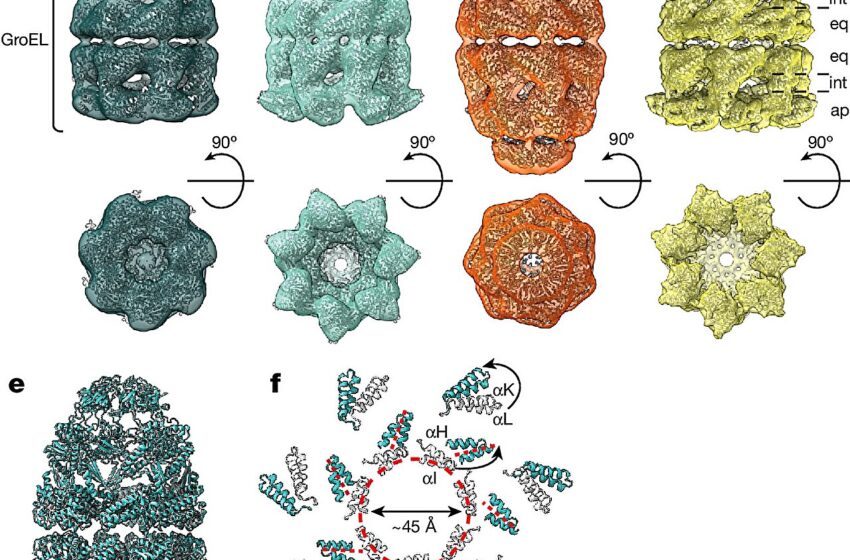
Structures in situ de complexes chaperonines. Crédit : Nature (2024). DOI : 10.1038/s41586-024-07843-w
La cryotomographie électronique (cryo-ET) permet de visualiser et d’analyser les structures cellulaires dans leur environnement naturel. Des chercheurs du MPI de biochimie de Martinsried et du centre médical universitaire de Göttingen ont utilisé la cryo-ET pour étudier les auxiliaires de repliement des protéines, appelés complexes chaperonines, chez la bactérie E. coli.
Ces chaperonines aident les protéines nouvellement synthétisées à se replier dans leur forme fonctionnelle correcte. Les chercheurs ont pu mettre en lumière la réaction de repliement avec un niveau de détail sans précédent, en surveillant les changements de conformation de la chaperonine ainsi que ses interactions avec la protéine cliente à l’intérieur des chambres de repliement.
Les résultats ont été publiés dans Nature.
Chaperonine auxiliaire de repliement des protéines
Les protéines sont les éléments moléculaires de base de la vie. Pour remplir une multitude de fonctions dans la cellule, chaque protéine doit adopter une structure tridimensionnelle définie, semblable aux composants des machines. Des assistants de repliement des protéines, appelés chaperonines, aident les protéines nouvellement synthétisées à atteindre leur forme fonctionnelle.
Le biochimiste F.-Ulrich Hartl, directeur du MPI de biochimie, explique : « Je travaille avec les chaperonines depuis plus de 30 ans. Ce complexe protéique existe inchangé dans presque tous les organismes vivants et est essentiel au bon repliement des protéines et à la survie des cellules. Les protéines mal repliées sont associées à des maladies telles que la maladie d’Alzheimer et la maladie de Parkinson. La compréhension de la structure et de la fonction des chaperonines pourrait nous aider à développer de nouvelles stratégies pour le traitement de ces maladies. »
Afin de mieux comprendre le fonctionnement des chaperonines, Hartl a collaboré avec les biologistes structuraux Wolfgang Baumeister, directeur émérite et inventeur de la cryo-ET au MPIB, et Rubén Fernández-Busnadiego de l’Institut de neuropathologie du Centre médical universitaire de Göttingen (UMG) et membre du pôle d’excellence « Bioimagerie multi-échelle : des machines moléculaires aux réseaux de cellules excitables » (MBExC).
Complexe chaperonine
Chez les bactéries, les complexes chaperonines sont constitués de deux sous-unités distinctes, GroEL et GroES. GroEL est organisé en deux anneaux empilés qui forment un tonneau. GroES agit comme un couvercle pour le tonneau GroEL. Les protéines nouvellement produites sont encapsulées dans le tonneau de taille nanométrique et peuvent se replier tout en étant protégées de l’environnement cellulaire.
Les chercheurs ont pu mettre en évidence deux formes principales du complexe GroEL-GroES dans les cellules, appelées « balle » et « ballon de football » (d’après la forme d’un ballon de football américain). Ces formes diffèrent par leur symétrie structurelle. Dans la forme balle, une capsule GroES est liée à un seul côté du corps GroEL. Cette forme a été trouvée principalement dans les bactéries en croissance normale. Des complexes en forme de ballon de football ont également été détectés.
Les images microscopiques ont également montré que les protéines à replier se trouvaient dans le tonneau de la chaperonine. Jonathan Wagner, chercheur à Martinsried et Göttingen, explique : « Il est fascinant de constater que la cryomicroscopie électronique est aujourd’hui si avancée que nous pouvons suivre des processus tels que le repliement des protéines avec autant de détails dans les cellules vivantes. »
Fernández-Busnadiego explique : « Dans cette étude, nous avons combiné la cryo-ET avec la cryo-microscopie électronique à particules uniques (cryo-EM) et la spectrométrie de masse quantitative. Cela nous a permis d’observer différentes conformations de complexes chaperonines dans différents états cellulaires et de déterminer leur abondance. La possibilité de visualiser ces complexes directement dans la bactérie au lieu de seulement dans le tube à essai représente une avancée majeure dans ce domaine et n’est devenue possible que récemment, car ce complexe chaperonine ne mesure que 14 nanomètres de large.
« Des décennies d’expériences avec des complexes GroEL/ES purifiés ont conduit à des résultats contradictoires sur le fonctionnement de ce mécanisme. Cela est probablement dû au fait que les expériences in vitro ne peuvent pas reproduire entièrement les conditions rencontrées à l’intérieur de la cellule. Nous pouvons désormais résoudre cette énigme grâce à la cryo-ET cellulaire, car nous pouvons imager les complexes à haute résolution dans des environnements cellulaires natifs et non perturbés. »
Hartl conclut : « Les résultats indiquent que lors du repliement des protéines assisté par les chaperonines, celles-ci s’assemblent différemment et alternent entre la forme asymétrique en « balle » et la forme symétrique en « ballon de football » au cours d’un même cycle de réaction. Dans le cadre de nos travaux futurs, nous nous attacherons à élucider les états intermédiaires de ces cycles pour comprendre comment ils sont régulés par les réactions chimiques de liaison et d’hydrolyse de l’ATP. »
Plus d’informations :
Ulrich Hartl, Visualisation de la fonction chaperonine in situ par cryotomographie électronique, Nature (2024). DOI : 10.1038/s41586-024-07843-w. www.nature.com/articles/s41586-024-07843-w
Fourni par l’Institut Max Planck de biochimie
Citation: Une étude Cryo-ET élucide les auxiliaires du repliement des protéines dans leur environnement naturel (2024, 21 août) récupéré le 21 août 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.
