Développer des organoïdes rénaux plus avancés pour modéliser la polykystose rénale
Crédit: Rapports de cellules (2023). DOI : 10.1016/j.celrep.2023.113431
Une équipe de chercheurs du CiRA, s’appuyant sur leurs travaux antérieurs sur la différenciation des cellules iPS en organoïdes rénaux, a apporté des améliorations significatives pour construire un meilleur modèle de développement et de maladies rénales destiné à être utilisé comme plate-forme robuste pour la découverte de médicaments.
La maladie polykystique rénale autosomique dominante (PKRAD) touche environ 1 personne sur 1 000 à 4 000 dans le monde. Même si la plupart des patients peuvent généralement mener une vie normale, les stades avancés de la maladie peuvent nécessiter une dialyse ou une transplantation. Bien que certains médicaments potentiellement utiles, tels que le Tolvaptan, soient disponibles pour aider à réduire la croissance des kystes, il s’agit d’une maladie génétique sans aucun traitement curatif.
Les organoïdes rénaux générés à partir de cellules souches pluripotentes induites par l'homme (hiPSC) représentent un outil biologique puissant qui peut nous fournir une meilleure compréhension du mécanisme de la maladie et un moyen de modéliser les maladies à des fins de découverte et de test de médicaments. Cependant, les organoïdes restent souvent au stade de développement et ne modélisent pas avec précision les conditions pathologiques chez les adultes.
Pour la PKD, des modèles organoïdes ont déjà été rapportés, mais aucun n'a pu atteindre le statut de maturation requis pour exprimer les molécules clés impliquées dans la formation du kyste du canal collecteur. En conséquence, la formation spontanée de kystes n’a jamais été observée dans de tels modèles, de sorte que les organoïdes rénaux générés à ce jour n’ont pas encore démontré leur plein potentiel pour la découverte et les tests de médicaments.
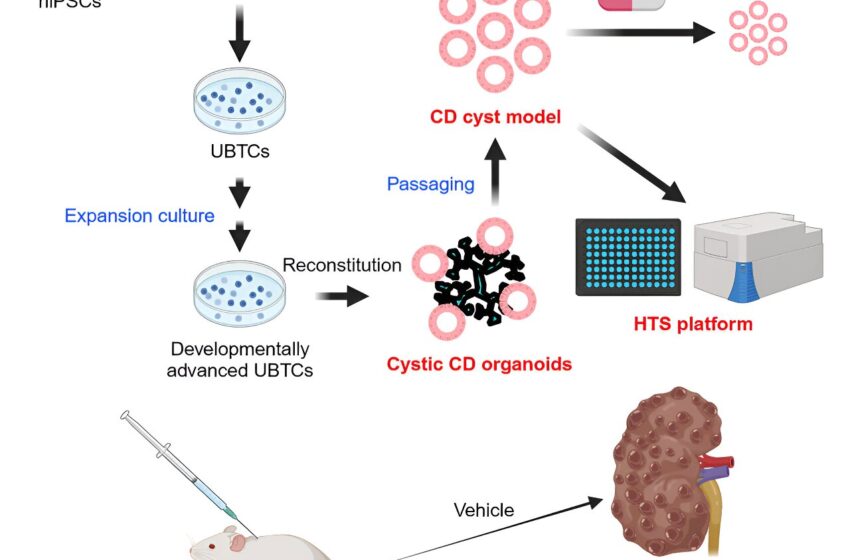
Dans une étude récente dirigée par le professeur Kenji Osafune (Département de croissance cellulaire et de différenciation), une équipe de chercheurs a réussi à générer des organoïdes de conduits collecteurs contenant des cellules corticales en établissant une méthode de culture d'expansion à long terme des cellules de l'extrémité du bourgeon urétéral (UBTC) pour atteindre la maturité requise pour modéliser la PKD avec précision. Les résultats sont publiés dans la revue Rapports de cellules.
L'équipe, notant que l'inhibition du TGF-β favorise la ramification et la population des organoïdes rénaux, a commencé par modifier le protocole de différenciation signalé précédemment en incorporant A83-01, un inhibiteur du TGF-β, dans le milieu de culture et en prolongeant la durée de culture de deux semaines. à six semaines. En effectuant le séquençage de l'ARN sur des organoïdes rénaux avec ou sans traitement A83-01 et en comparant leurs profils d'expression génique, les chercheurs ont identifié et vérifié, par inhibition chimique, la voie NFκB comme étant essentielle à la prolifération de l'UBTC.
En utilisant ces UBTC plus matures, l’équipe de recherche a incité la formation de conduits collecteurs au cours d’un processus de différenciation d’une semaine. Bien que les cellules principales des canaux collecteurs puissent être générées à partir d'UBTC en culture pendant deux ou six semaines, les UBTC cultivés à long terme (6 semaines) ont montré un profil d'expression génique cohérent avec une phase de ramification tardive plus développée, non affichée par les UBTC cultivés à court terme. De plus, la réponse inflammatoire et les marqueurs liés à la sénescence cellulaire ont été régulés positivement dans les UBTC les plus matures, ce qui correspond à un passage progressif vers une croissance plus lente.
Ensuite, les chercheurs se sont concentrés sur la collecte d'organoïdes canalaires générés à partir d'UBTC cultivés pendant deux ou six semaines et identifiés par séquençage d'ARN unicellulaire des cellules du canal collecteur médullaire interne (IMCD), des cellules épithéliales de la pointe papillaire, des cellules principales du canal collecteur médullaire externe (OMCD), cellules principales du canal collecteur cortical (CCD) et cellules des tubules de connexion.
Notamment, une comparaison complète de ces organoïdes et des organoïdes rapportés précédemment a révélé que même si les cellules CCD n'étaient pas présentes dans les organoïdes du rapport précédent, elles étaient dans les organoïdes générés dans cette étude, avec une proportion légèrement plus élevée de ce type de cellule dans les organoïdes différenciés des organoïdes longs. -terme UBTC cultivés. Une analyse approfondie menée par les chercheurs a identifié des changements supplémentaires dans l'expression des gènes qui indiquent un statut de développement plus avancé pour ces organoïdes.
Pour déterminer si les humains et les souris partagent des mécanismes de développement rénaux similaires et si ces organoïdes des canaux collecteurs pourraient être utilisés pour modéliser la PKD, les chercheurs ont généré des hiPSC PKD1 KO homozygotes par CRISPR/Cas9 parce que les souris Pkd1 KO développent des kystes au cours du développement embryonnaire.
L’équipe a observé la formation spontanée de kystes dans PKD1 KO, mais pas dans les organoïdes des canaux collecteurs de contrôle de type sauvage (WT). De plus, les chercheurs ont découvert que ces kystes formés spontanément réagissaient aux manipulations (par exemple, signalisation AMP cyclique et production de cholestérol) censées affecter la formation des kystes, démontrant ainsi qu'ils récapitulaient avec précision leurs homologues in vivo.
Pour déterminer l'utilité de ces organoïdes de conduits collecteurs pour le criblage à haut débit afin d'identifier de petites molécules potentiellement utiles pour le traitement de la PKD, les chercheurs ont créé une plateforme basée sur des plaques à 96 puits et testé plusieurs médicaments candidats actuellement examinés dans des essais cliniques (par exemple, le venglustat , bardoxolone méthyle et tesevatinib) et le tolvaptan, un médicament approuvé par la FDA pour la PKD, et ont constaté qu'ils étaient efficaces pour supprimer l'agrandissement et/ou la formation de kystes.
Les chercheurs ont observé que le TTNPB, un agoniste du récepteur de l'acide rétinoïque (RAR), supprime l'élargissement du kyste tout en établissant la plateforme de dépistage des médicaments. De plus, l’acide tout-trans rétinoïque (ATRA) s’est avéré en parallèle avoir des effets similaires, confirmant ainsi la signalisation RAR en tant que cible thérapeutique putative pour la PKD.
L'analyse par micropuce des organoïdes des canaux collecteurs formant des kystes traités avec ou sans TTNPB a révélé l'implication potentielle de plusieurs voies de signalisation, notamment le TGF-β, la synthèse du cholestérol, le transport et la glycolyse du glucose, ainsi que la sénescence cellulaire. En se concentrant sur la sénescence cellulaire et la régulation positive de CDKN2B par TTNPB, les chercheurs ont généré une lignée hiPSC avec une expression inductible de CDKN2B et ont découvert que l'élargissement du kyste était atténué par sa surexpression, le mettant ainsi en valeur comme une cible médicamenteuse viable pour le traitement par AKPKD.
Étant donné que l'ATRA est déjà utilisé en clinique pour traiter la leucémie promyélocytaire aiguë, l'équipe de recherche a testé son efficacité sur un modèle murin d'AKPKD (souris Pkd1 KO spécifiques aux reins), qui développe une maladie kystique rénale sévère, mortelle environ deux semaines après la naissance. Des améliorations qualitatives et quantitatives significatives ont été détectées dans les reins de souris traitées par ATRA, justifiant ainsi des études précliniques et cliniques supplémentaires sur l'ATRA et d'autres agonistes du RAR pour le traitement de la PKRAD.
Remarquablement, les méthodes modifiées de culture d’expansion et de différenciation à long terme afin de générer des organoïdes de conduits collecteurs contenant des cellules corticales plus matures ouvrent la porte à diverses recherches fondamentales et applications cliniques. Comme l'a démontré l'équipe de recherche dans cette étude, ils possèdent un énorme potentiel d'études visant à approfondir notre compréhension de la pathogenèse et du traitement de la PKD et à fonctionner comme une plate-forme robuste à des fins de découverte et de test de médicaments.
Plus d'information:
Shin-Ichi Mae et al, Cystogenèse de modèle organoïde de canal collecteur rénal dérivé d'iPSC humaine dans la PKD, Rapports de cellules (2023). DOI : 10.1016/j.celrep.2023.113431
Fourni par l'Université de Kyoto
Citation: Développement d'organoïdes rénaux plus avancés pour modéliser la maladie polykystique rénale (1er décembre 2023) récupéré le 1er décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.

