La recherche révèle un changement rare du rôle d’une enzyme lors de l’assemblage du système de défense bactérien
Résumé graphique. Crédit: Cellule moléculaire (2023). DOI : 10.1016/j.molcel.2023.11.007
Les scientifiques ont révélé un phénomène sans précédent dans une protéine : seule, l’enzyme traite l’ADN et l’ARN mais, lorsqu’elle est liée à une autre protéine dans le cadre d’un système de défense, elle interagit avec un type de composé complètement différent pour aider les bactéries à se suicider.
Cette découverte a été réalisée alors que les chercheurs se concentraient sur le fonctionnement de ce mécanisme de défense chez les bactéries infectées par des phages, des virus qui envahissent et se copient à l'intérieur des cellules bactériennes. En plus de détailler les structures et les sites de liaison des protéines, les expériences ont mis au jour ce changement sans précédent dans les fonctions enzymatiques.
“C'était une grande découverte”, a déclaré l'auteur principal de l'étude, Tianmin Fu, professeur adjoint de chimie biologique et de pharmacologie à la faculté de médecine de l'Ohio State University. “Lorsque les protéines forment un complexe, cela augmente ou diminue généralement l'activité d'une enzyme, mais nous n'avons jamais vu de changement complet de fonction. C'est entièrement nouveau dans le domaine de l'enzymologie.”
Dans une perspective plus large, a-t-il déclaré, une meilleure compréhension de la manière dont les bactéries utilisent leurs systèmes de défense pour mourir plutôt que de rester infectées par les phages pourrait se traduire par des thérapies qui convaincraient les cellules cancéreuses de programmer également leur propre mort.
“Si nous pouvions introduire ce type de système dans une cellule cancéreuse, cela pourrait conduire au développement d'une nouvelle stratégie de traitement du cancer”, a déclaré Fu, également chercheur au Comprehensive Cancer Center de l'Ohio State University.
La recherche est publiée dans Cellule moléculaire.
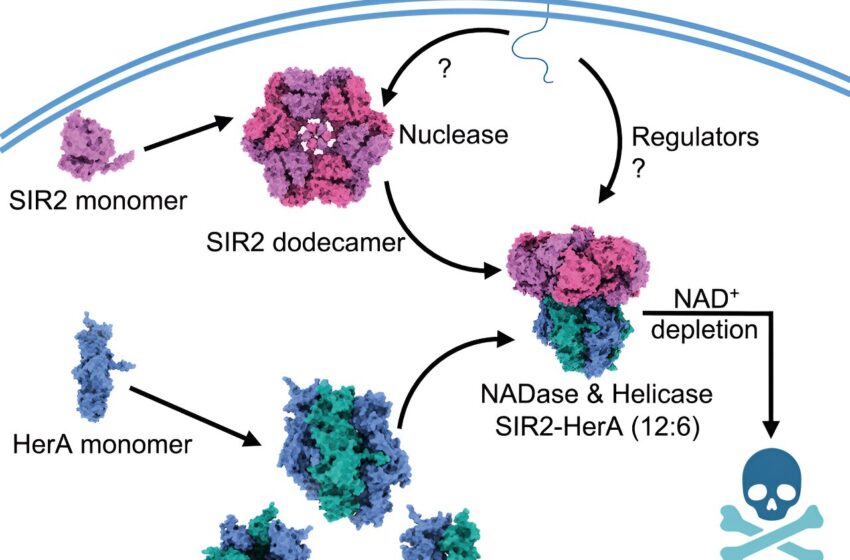
Lorsqu’elles sont infectées par des phages, les bactéries choisissent la mort pour empêcher les phages de s’emparer d’une communauté bactérienne. Le complexe examiné dans cette étude, la combinaison de protéines appelées SIR2 et HerA, a été identifié ainsi que des centaines d’autres systèmes de défense bactériens lors de recherches antérieures axées sur les analyses génomiques.
Dans un modèle d'E. coli, Fu et ses collègues ont utilisé la microscopie cryoélectronique pour déterminer les structures biochimiques des protéines seules et pendant et après leur assemblage en tant que complexe supramoléculaire.
“Ce système a été identifié chez de nombreuses bactéries différentes, et bien que nous l'ayons étudié chez E. coli, nous pensons qu'il fonctionnerait de manière très similaire chez d'autres bactéries”, a déclaré Fu.
L'analyse suggère que SIR2 et HerA ont une affinité l'un pour l'autre, montrant que la structure en forme de roue de SIR2 fonctionne comme un organisateur de groupes moléculaires HerA avant que les deux ne s'installent dans un complexe composé de six sous-unités moléculaires identiques. Cependant, ce qui déclenche exactement leur connexion reste un mystère.
Les résultats ont montré qu'une fois assemblé, le complexe pourrait exister dans les bactéries sans incident, ce qui suggère que les bactéries inhibent d'une manière ou d'une autre l'activité de défense du système à moins qu'un phage n'entre en scène. Lorsque les phages ont été introduits, les bactéries sont rapidement mortes, de leur propre chef, car le système de défense avait été activé pour épuiser une petite molécule appelée NAD+ dont les bactéries ont besoin pour survivre. Ce mécanisme d’activation reste également inconnu pour l’instant.
Les expériences ont confirmé que SIR2 était responsable de l’élimination du NAD+, ce qui était une surprise. La première tâche de SIR2 en tant que nucléase consiste à digérer les acides nucléiques pour maintenir les fonctions cellulaires appropriées. Mais lorsqu'il est lié à HerA et activé dans le cadre du système de défense, sa fonction enzymatique a changé : SIR2 est devenu un type d'enzyme totalement différent appelé NADase, qui génère une réaction à base d'eau pour dissiper le NAD+.
“Nous voulons maintenant aborder cette énorme question biologique fondamentale : comment un assemblage complexe fait-il passer l'activité de SIR2 d'une nucléase à une NADase ?” dit Fu. “Découvrir ce mécanisme serait important pour le domaine, et ce système est extrêmement intéressant car il comporte de nombreuses activités enzymatiques différentes dans un complexe préassemblé.”
Fu envisage également une boîte à outils de biologie synthétique du futur dans laquelle les astuces bactériennes sont adaptées aux stratégies de destruction des cellules cancéreuses. “Nous commençons à apprendre des bactéries et nous espérons pouvoir les reprogrammer pour en faire des outils puissants pour le diagnostic et le traitement du cancer”, a-t-il déclaré.
Plus d'information:
Zhangfei Shen et al, Activation médiée par l'assemblage du complexe supramoléculaire SIR2-HerA pour la défense anti-phage, Cellule moléculaire (2023). DOI : 10.1016/j.molcel.2023.11.007
Fourni par l'Université d'État de l'Ohio
Citation: La recherche révèle un changement de rôle enzymatique rare lors de l'assemblage du système de défense bactérien (13 décembre 2023) récupéré le 13 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.

